Свойства углекислого газа
В 17 веке Жан-Батист Ван Гельмонт из Фландрии открыл углекислый газ и определил его формулу. Подробное исследование и описание было сделано столетие спустя шотландцем Джозефом Блэком. Он исследовал свойства углекислого газа и провел серию опытов, в которых доказал, что он выделяется при дыхании животных.
В нормальных условиях не обладает вкусом, цветом и запахом. Только вдыхая большое его количество, человек ощущает кислый привкус. Его дает угольная кислота, образующаяся в малых дозах при растворении углекислого газа в слюне. Эта особенность применяется для приготовления газированных напитков. Пузырьки в шампанском, просекко, пиве и лимонаде — это и есть углекислый газ, образовавшийся в результате естественных процессов брожения или добавленный в напиток искусственно.
Физические свойства углекислого газа
Плотность углекислого газа больше плотности воздуха, поэтому при отсутствии вентиляции он скапливается внизу. Он не поддерживает окислительные процессы, такие, как дыхание и горение.
Поэтому углекислоту применяют в огнетушителях. Это свойство углекислого газа иллюстрируют с помощью фокуса — горящую свечу опускают в «пустой» стакан, где она и гаснет. В действительности стакан заполнен CO2.
Диоксид углерода получение — основные методы.
Процесс получения диоксида углерода может быть разным, в зависимости от желаемого результата и целей его использования. В данной статье мы рассмотрим несколько основных методов получения диоксида углерода.Первым методом является процесс сжигания углеводородов.
В результате сжигания углеводородов, таких как природный газ или нефть, образуется диоксид углерода. Этот метод является наиболее распространенным и эффективным способом получения диоксида углерода в промышленных масштабах. Однако он имеет серьезный недостаток — выбросы СО2, которые являются одним из основных источников парниковых газов и способствуют глобальному потеплению.Вторым методом является процесс ферментации.
Ферментация — это биохимический процесс, при котором органические вещества разлагаются в присутствии ферментов. В результате этого процесса образуется диоксид углерода. Ферментация используется в производстве различных алкогольных напитков, таких как вино и пиво, а также в производстве хлеба и других продуктов. Однако этот метод является менее эффективным для получения диоксида углерода в промышленных масштабах, поэтому он используется главным образом для производства различных товаров.Третий метод — химический процесс.
Существуют различные химические процессы, которые позволяют получать диоксид углерода. Один из наиболее распространенных методов — это процесс извлечения диоксида углерода из природных ресурсов, таких как природный газ или нефть. В результате этого процесса диоксид углерода может быть получен в чистом виде. Однако этот метод также имеет недостатки — высокая стоимость и негативное влияние на окружающую среду.Четвертым методом является процесс с использованием специальных установок по получению диоксида углерода.
Качественная реакция
Одним из возможных способов обнаружения газообразного диоксида углерода является изменение прозрачности известкового раствора.
Ca(OH)2 + CO2 = CaCO3&darr- + H2O.
Этот опыт известен еще из школьного курса химии. В начале реакции образуется небольшое количество белого осадка, который впоследствии исчезает при пропускании через воду углекислого газа. Изменение прозрачности происходит потому, что в процессе взаимодействия нерастворимое соединение — карбонат кальция превращается в растворимое вещество — гидрокарбонат кальция. Реакция протекает по такому пути:
CaCO3 + H2O + CO2 = Ca(HCO3)2.
Химические и биологические свойства углекислого газа
Углекислый газ обладает кислотными свойствами, так как является кислотным оксидом, и при растворении в воде образует угольную кислоту:
CO₂+H₂O=H₂CO₃
Вступает в реакцию со щелочами, в результате чего образуются карбонаты и гидрокарбонаты. Этот газ не подвержен горению. В нем горят только некоторые активные металлы, например, магний.
При нагревании углекислый газ распадается на угарный газ и кислород:
2CO₃=2CO+O₃.
Как и другие кислотные оксиды, данный газ легко вступает в реакцию с другими оксидами:
СaO+Co₃=CaCO₃.
Углекислый газ входит в состав всех органических веществ. Круговорот этого газа в природе осуществляется с помощью продуцентов, консументов и редуцентов. В процессе жизнедеятельности человек вырабатывает примерно 1 кг углекислого газа в сутки. При вдохе мы получаем кислород, однако в этот момент в альвеолах образуется углекислый газ. В этот момент происходит обмен: кислород попадает в кровь, а углекислый газ выходит наружу.
Получение углекислого газа происходит при производстве алкоголя. Также этот газ является побочным продуктом при получении азота, кислорода и аргона. Применение углекислого газа необходимо в пищевой промышленности, где углекислый газ выступает в качестве консерванта, а также углекислый газ в виде жидкости содержится в огнетушителях.

Рис. 3. Огнетушитель.
Применение
Получение диоксида углерода
Существует несколько способов получения диоксида углерода. В промышленности двуокись углерода получают из доломита, известняка – продуктов разложения природных карбонатов, а также из печных газов. Газовую смесь промывают раствором карбоната калия. Смесь поглощает двуокись углерода и превращается в гидрокарбонат. Раствор гидрокарбоната нагревают и он, разлагаясь, высвобождает углекислоту. При промышленном методе получения диоксид углерода закачивается в баллоны.
В лабораториях получение диоксида углерода основывается на взаимодействии гидрокарбонатов и карбонатов с кислотами.
Причины образования инея на баллоне
Постараемся разобраться, почему происходит так, что замерзает газ в баллоне, находящемся на улице, при понижении температуры воздуха. Так, для начала нужно понять, что охлаждение частиц происходит при интенсивном высвобождении газа из баллона. Поскольку газ внутри емкости закачивается под давлением, он сконцентрирован в жидком состоянии. Вследствие этого происходит частичное замерзание жидкого газа во время его высвобождения.
Причина первая — низкая температура воздуха
Исходя из практики использования баллонов, оптимальная температура при которой оборудование будет нормально работать составляет примерно 10 градусов, а при снижении этой отметки, начинаются проблемы с подачей газа в систему.
Если ваше оборудование находится в помещении с отоплением, тогда не стоит обращать внимание на эти показатели. Также не стоит беспокоиться о том, что ваш газовый баллон замерзнет и выйдет из строя, если оставить его в помещении без отопления в зимнюю пору года
Зимняя температура слишком маленькая, чтобы полностью заморозить топливо.
Причина вторая — высокое содержание бутана
А сейчас разберемся, может ли замерзнуть газ, который находится внутри баллона, и как это предотвратить. Так, чтобы обеспечить правильную работу газовых приборов, необходимо соблюдать правильное соотношение пропана и бутана. Правильные пропорции помогут достичь максимального потребления топлива и корректной работы приборов при отрицательной температуре окружающей среды.
Пропорции топлива летом
Как уже было сказано раньше, температура замерзания бутана, отличается от граничной температуры замерзания пропана. Путём практических исследований были выведены оптимальные пропорции для работы оборудования зимой и летом.
Для теплого времени года, топливо смешивается в таких пропорциях:
- Пропан – 40 %;
- Бутан 60 %.
Такое соотношение считается наиболее эффективным для потребления. Стоит отметить, что этот вариант имеет более низкую стоимость, чем топливо с «зимней» пропорцией.
Зимние пропорции топлива
Для использования газовых баллонов зимой пропорции будут другими, а именно:
- Пропан – 60 %;
- Бутан – 40 %.
В некоторых случаях количество пропана может достигать 80 процентов. Но, исходя из того, что пропан стоит дороже, чем бутан, итоговая цена на топливо также будет выше.
Причина третья — повышенное потребление газа
Но всё же, почему емкость покрывается инеем только в том месте, где газ находится в жидком состоянии? Низкая температура окружающей среды – не единственная причина обмерзания. Как известно, газовая плита, камин или другое оборудование, которое работает от газового баллона, функционирует при преобразовании газа из жидкого состояния в парообразный вид.
Есть два варианта преобразования газа, а именно:
- нагревание топлива;
- естественное испарение.
В этом случае все частицы с мощной кинетической энергией стремительно направляются в верхнюю часть емкости и отделяются от частиц в жидком состоянии с меньшим кинетическим потенциалом.
Газ, который пребывает в жидком состоянии внутри баллона, всегда находится внизу, а паровая часть стремится вверх. Таким образом и осуществляется высвобождение топлива и подача его в газовую плиту или другое оборудование
В связи с такими условиями жидкое топливо начинает терять температуру. Из этого следует, что при повышении потребления газа понижается температура его жидкого состояния. Проще говоря, чем больше топлива потребляет оборудование, тем быстрее будет замерзать газовый баллон.
По мере охлаждения частиц понижается способность самостоятельного испарения сжиженного газа. Отсюда следует, чем холоднее будут частицы, тем медленнее будет испаряться газ. При этом оборудование начинает работать с перебоями или вовсе перестаёт функционировать.
Основные свойства
Углерод инертен по отношению ко всем обычным растворителям. Исключение — некоторые расплавленные металлы. Однако после остывания он снова кристаллизуется в графит.
При нормальных условиях более химически активный только черный углерод. Он может соединяться со фтором, а при повышении температуры — с водородом, кремнием, серой, бором и некоторыми другими металлами. В результате реакции образуются карбиды:
- 4Al + 3C → Al4C3.
- Ca + 2C → CaC2.
При взаимодействии карбидов с водой или кислотой образуется метан или ацетилен:
- Al4C3 + 12HCl → 4AlCl3 + 3CH4 (метан).
- CaC2 + 2H2O → C2H2 (ацетилен) + Ca (OH)2 (гидроксид кальция).
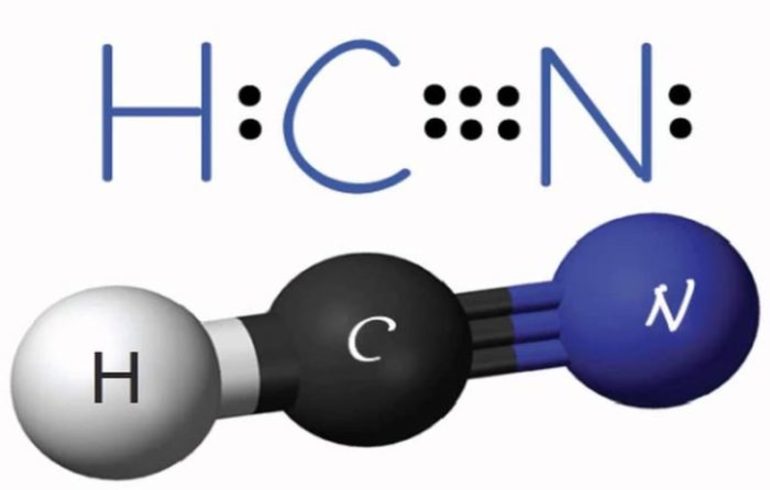
С азотом углерод не соединяется, но в присутствии водорода образует циановодород (формула вещества HCN). В реакциях с кислородом он образует монооксид и диоксид, при этом выделяется большое количество тепла:
- C + O2 → CO2.
- монооксид чаще всего выделяется при пропускании диоксида над раскаленным углем: CO2 + C → 2CO.
Углерод — один из наиболее сильных восстановителей, известных в химии. При взаимодействии с оксидами металлов он «отнимает» у них кислород, восстанавливая при этом вещества до свободного состояния:
- ZnO + C → Zn + CO.
- SiO2 +2C → Si + 2CO.
С галогенами «чистый» углерод не взаимодействует. Соединения с ними образуются из других веществ (например, углеводородов).
Физиологическое действие
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель , обозначается на упаковке кодом Е290
.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги . При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений
Углекислый газ используется для газирования лимонада и газированной воды . Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл . В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний . Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31°С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31°С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа,- таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки .
«Одеяло Земли»
Углекислый газ (двуокись углерода, диоксид углерода, CO2) формируется при соединении двух элементов: углерода и кислорода. Он образуется в процессе сжигания угля или углеводородных соединений, при ферментации жидкостей, а также как продукт дыхания людей и животных. В небольших количествах он содержится и в атмосфере, откуда он ассимилируется растениями, которые, в свою очередь, производят кислород.
Углекислый газ бесцветен и тяжелее воздуха. Замерзает при температуре −78.5°C с образованием снега, состоящего из двуокиси углерода. В виде водного раствора он образует угольную кислоту, однако она не обладает достаточной стабильностью для того, чтобы ее можно было легко изолировать.
Углекислый газ — это «одеяло» Земли. Он легко пропускает ультрафиолетовые лучи, которые обогревают нашу планету, и отражает инфракрасные, излучаемые с ее поверхности в космическое пространство. И если вдруг углекислый газ исчезнет из атмосферы, то это в первую очередь скажется на климате. На Земле станет гораздо прохладнее, дожди будут выпадать очень редко. К чему это в конце концов приведет, догадаться нетрудно.
Правда, такая катастрофа нам пока еще не грозит. Скорее даже, наоборот. Сжигание органических веществ: нефти, угля, природного газа, древесины – постепенно увеличивает содержание углекислого газа в атмосфере. Значит, со временем надо ждать значительного потепления и увлажнения земного климата. Кстати, старожилы считают, что уже сейчас заметно теплее, чем было во времена их молодости…
Двуокись углерода выпускается жидкая низкотемпературная, жидкая высокого давления и газообразная. Ее получают из отбросных газов производств аммиака, спиртов, а также на базе специального сжигания топлива и других производств. Газообразная двуокись углерода – газ без цвета и запаха при температуре 20°С и давлении 101,3 кПа (760 мм рт. ст.), плотность – 1,839 кг/м3. Жидкая двуокись углерода – просто бесцветная жидкость без запаха.
Углекислый газ нетоксичен и невзрывоопасен. При концентрациях более 5% (92 г/м3) двуокись углерода оказывает вредное влияние на здоровье человека — она тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
С + СО2 = 2СО.
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации — угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция — горение магния:
2Mg + CO2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.
В химических соединениях СО2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Na2O + CO2 = Na2CO3;
2NaOH + CO2 = Na2CO3 + H2O;
NaOH + CO2 = NaHCO3.
Видео: Галилео. Эксперимент. Опыт с углекислым газом
Биохимики выяснили, что для повышения урожайности различных культур весьма эффективно удобрять воздух углекислым газом. Однако данный способ удобрения можно применять только в оранжереях. В сельском хозяйстве газ применяют для создания искусственного дождя. При нейтрализации щелочной среды двуокись углерода заменяет сильнодействующие минеральные кислоты. В овощехранилищах углекислый газ применяют для создания газовой среды.
В парфюмерной промышленности двуокись углерода применяют при изготовлении духов. В медицине углекислый газ используют для антисептического воздействия при проведении открытых операций.
При охлаждении углекислый газ превращается в «сухой лед». Сжиженный диоксид углерода расфасовывают в баллоны и отправляют потребителям. Углекислый газ в виде «сухого льда» используют для сохранения пищевых продуктов. Такой лед при нагревании испаряется без остатка.
Углекислый газ используют как активную среду при сварке проволокой. При сварке двуокись углерода разлагается на кислород и угарный газ. Кислород вступает во взаимодействие с жидким металлом и окисляет его.
Применение диоксида углерода
Пищевая промышленность после масштабного получения «сухого льда» перешла на принципиально новый метод хранения продуктов. Он незаменим при производстве газированных напитков и минеральной воды. Содержание СО2 в напитках придает им свежесть и заметно увеличивает срок хранения. А карбидизация минеральных вод позволяет избежать затхлости и неприятного вкуса.
В кулинарии часто используют метод погашения лимонной кислоты уксусом. Выделяющийся при этом углекислый газ придает пышность и легкость кондитерским изделиям.
Данное соединение часто используется в качестве пищевой добавки, повышающей срок хранения пищевых продуктах. Согласно международным нормам классификации химических добавок содержания в продуктах, проходит под кодом Е 290,
Порошкообразный углекислый газ — одно из наиболее популярных веществ, входящих в состав пожаротушительных смесей. Это вещество встречается и в пене огнетушителей.
Транспортировать и хранить углекислый газ лучше всего в металлических баллонах. При температуре более 31 С давление в баллоне может достигнуть критического и жидкий СО2 перейдет в сверхкритическое состояние с резким подъемом рабочего давления до 7,35 МПа. Металлический баллон выдерживает внутреннее давление до 22 МПа, поэтому диапазон давления при температурах свыше тридцати градусов признается безопасным.
Внимание, только СЕГОДНЯ!
Основные области применения СО 2 :
- в машиностроении и строительстве (для сварки и прочее);
- для холодной посадки частей машин;
- в процессах тонкой заточки;
- для электросварки, основанной на принципе защиты расплавленного металла от вредного воздействия атмосферного воздуха;
- в металлургии;
- продувка углекислым газом литейных форм;
- при производстве алюминия и других легкоокисляющихся металлов;
- в сельском хозяйстве для создания искусственного дождя;
- в экологии заменяет сильнодействующие минеральные кислоты для нейтрализации щелочной отбросной воды;
- в изготовлении противопожарных средств;
- применяется в углекислотных огнетушителях в качестве огнетушащего вещества, эффективно останавливает процесс горения;
- в парфюмерии при изготовлении духов;
- в горнодобывающей промышленности;
- при методе беспламенного взрыва горных пород;
- в пищевой промышленности;
- используется как консервант и обозначается на упаковке кодом Е290;
- в качестве разрыхлителя теста;
- для производства газированных напитков;
Оксиды углерода
Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
С + СО 2 = 2СО.
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации — угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция — горение магния:
2Mg + CO 2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.

В химических соединениях СО 2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Na 2 O + CO 2 = Na 2 CO 3 ;
2NaOH + CO 2 = Na 2 CO 3 + H 2 O;
NaOH + CO 2 = NaHCO 3 .
Вредность и опасность углекислого газа
Двуокись углерода нетоксична и невзрывоопасна. При концентрациях более 5% (92 г/м3) углекислый газ оказывает вредное влияние на здоровье человека, так как он тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья. Помещения, где производится сварка с использованием углекислоты, должны быть оборудованы общеобменной приточно-вытяжной вентиляцией. Предельно допустимая концентрация углекислого газа в воздухе рабочей зоны 9,2 г/м3 (0,5%).
Химические и биологические свойства углекислого газа
Как получают углекислый газ
Для того, чтобы использовать СО2, потребуется сначала его получить. Есть несколько основных методов получения такого сырья. К ним относятся:
- Адсорбция моноэтаноламина. В таком случае собираются вещества, которые вырабатываются в процессе обработки отходов. При этом обеспечивается нужный уровень температуры и давления. Таким образом удается высвободить достаточное количество газа.
- Брожение сырья. Позволяет гарантировать получение качественного углекислого газа. В процессе производства используются уголь, водород или перманганат калия. При нагнетании достаточного уровня давления, удается добиться выработки жидкого варианта вещества.
- Обработка отходов производства. Для создания сухого льда используют отходы производства алкоголя — от ликероводочных и пивоваренных заводов.
Соблюдение технических требований гарантирует, что вещество будет качественным, чистым и готовым к использованию. Газ закачивается в баллоны или более крупные емкости, отправляется к потребителям.
Что такое углекислый газ
В закрытых помещениях основным источником CO2 является человек. Каждый час взрослый человек выдыхает до 20 литров (0,5 кубического метра) газа в состоянии покоя и до 35-40 литров во время энергичной физической активности.
В зависимости от характера помещения, дополнительный углекислый газ может вырабатываться газовым котлом и кухней.
Средняя допустимая плотность углекислого газа в помещении составляет 600 ppm, поэтому необходимо регулярно проветривать все жилые и технические помещения, активировать соответствующие системы вентиляции или просто открывать окна на короткое время.
Углекислый газ примерно в полтора раза тяжелее свежего воздуха и поэтому накапливается в подземных и наземных помещениях.
Углекислый газ в атмосфере
Свойства углекислого газа таковы, что его запах невозможно почувствовать при нормальных условиях. Ощущения запаха и вкуса возникают только при повышенных концентрациях — кислый вкус во рту, вызванный образованием небольшого количества углекислого газа под воздействием влаги слизистой оболочки.
Растворимость углекислого газа в воде и сиропе используется в пищевой промышленности для производства различных напитков.
Газ не участвует в горении, что, естественно, привело к его использованию в современных огнетушителях (например, углекислотных). Токсичность отсутствует, другие свойства с точки зрения безопасности для человека должны быть тщательно оценены.

Самый важный
- газ препятствует выходу инфракрасного излучения с планеты в окружающее пространство;
- температура атмосферы год за годом увеличивается;
- происходят изменения природных явлений и климата;
- текущий формат этих преобразований – ускоренное таяние ледниковых «шапок», повышение уровня Мирового океана и изменения в составе биосферы.




























