Содержание
В гидроксид аммония представляет собой соединение с молекулярной формулой NH4ой ой5NO образуется при растворении газообразного аммиака (NH3) в воде. По этой причине ее называют аммиачной водой или жидким аммиаком.
Это бесцветная жидкость с очень интенсивным и резким запахом, который невозможно изолировать. Эти характеристики напрямую связаны с концентрацией NH.3 растворяется в воде; концентрация, которая на самом деле, будучи газом, может содержать огромное количество его, растворенного в небольшом объеме воды.
Достаточно небольшая часть этих водных растворов состоит из катионов NH.4+ и анионы ОН–. С другой стороны, в очень разбавленных растворах или в замороженных твердых веществах при очень низких температурах аммиак может быть найден в форме гидратов, таких как: NH3∙ H2Или, 2NH3∙ H2O и NH3∙ 2H2ИЛИ.
Любопытный факт: облака Юпитера состоят из разбавленных растворов гидроксида аммония. Однако космический зонд «Галилео» не смог найти воду в облаках планеты, чего можно было ожидать, учитывая имеющиеся у нас знания об образовании гидроксида аммония; то есть это кристаллы NH4ОН полностью безводный.
Ион аммония (NH4+) образуется в просвете почечных канальцев путем объединения аммиака и водорода, секретируемого клетками почечных канальцев. Аналогичным образом аммиак вырабатывается в клетках почечных канальцев в процессе превращения глутамина в глутамат и, в свою очередь, в превращении глутамата в α-кетоглутарат.
Аммиак производят в промышленных масштабах по методу Габера-Боша, при котором газы азота и водорода вступают в реакцию; с использованием иона трехвалентного железа, оксида алюминия и оксида калия в качестве катализаторов. Реакция проводится при высоком давлении (150-300 атмосфер) и высокой температуре (400-500 ºC) с выходом 10-20%.
Аммиак образуется в реакции, которая при окислении дает нитриты и нитраты. Они необходимы для получения азотной кислоты и удобрений, таких как нитрат аммония.
растворимость
NH4ОН, поскольку в земных условиях соли нет, невозможно оценить, насколько она растворима в разных растворителях..
Однако можно было бы ожидать, что он будет чрезвычайно растворим в воде, так как при его растворении выделяется огромное количество NH.3. Теоретически, это был бы удивительный способ хранения и транспортировки аммиака..
Можно ожидать, что в других растворителях, способных принимать водородные связи, таких как спирты и амины, он также будет очень растворим в них. Здесь катион NH4+ является донором водородных мостиков, а ОН- это работает как.
Примерами этих взаимодействий с метанолом могут быть: H3N+-H — OHCH3 и HO- — HOCH3 (OHCH3 указывает на то, что кислород получает водородную связь, а не на то, что метильная группа связана с Н).
приложений
В еду
-Он используется в качестве добавки во многих пищевых продуктах, в которых он действует как разрыхлитель, регулятор pH и отделочный агент поверхности пищи..
-Список продуктов, в которых используется гидроксид аммония, обширен и включает выпечку, сыры, шоколад, конфеты и пудинги.
-Гидроокись аммония классифицируется FDA как безопасное вещество для обработки пищевых продуктов при условии соблюдения установленных стандартов..
-В мясных продуктах он используется в качестве антимикробного агента, способного уничтожать бактерии, такие как кишечная палочка, и снижать его до неопределяемого уровня. Бактерия обнаружена в кишечнике крупного рогатого скота, адаптируясь к кислой среде. Гидроксид аммония, регулируя рН, препятствует росту бактерий.
терапевтический
-Гидроксид аммония имеет несколько терапевтических применений, в том числе:
-10% раствор используется как стимулятор дыхательного рефлекса
-Внешне он используется на коже для лечения укусов и укусов насекомых. Он действует на пищеварительную систему как антацидное и ветрогонное средство, то есть помогает устранять газы..
Кроме того, он используется в качестве местного средства для лечения острых и хронических мышечно-скелетных болей. Как следствие рубцового действия гидроксида аммония наблюдается местное усиление кровотока, покраснение и раздражение.
Промышленное и разное
-Он действует в сокращении NOx (высокореактивных газов, таких как оксид азота (NO) и диоксид азота (NO)2)) для дымовых выбросов и сокращения выбросов NOx в дымовых трубах.
-Используется в качестве пластифицирующего агента; Добавка красок и для обработки поверхностей.
-Это увеличивает пористость волос, позволяя пигментам пятен иметь большее проникновение, что обеспечивает лучший результат.
-Гидроксид аммония используется в качестве антимикробного агента при очистке сточных вод. Кроме того, он вмешивается в синтез хлорамина. Это вещество выполняет функцию, аналогичную хлору, при очистке воды в плавательном бассейне, имея преимущество в том, что она менее токсична..
-Используется в качестве ингибитора коррозии в процессе переработки нефти..
-Он используется в качестве чистящего средства в различных промышленных и коммерческих продуктах, используемых на нескольких поверхностях, в том числе: нержавеющая сталь, фарфор, стекло и духовка..
-Кроме того, он используется в производстве моющих средств, мыла, фармацевтических препаратов и чернил.
В сельском хозяйстве
Гидроксид аммония, хотя и не применяется непосредственно в качестве удобрения, выполняет эту функцию. Аммиак производится из атмосферного азота по методу Хабера-Боша и транспортируется в холодильнике ниже точки кипения (-33 ° С) к местам его использования.
Аммиак под давлением впрыскивается в виде пара в почву, где он немедленно вступает в реакцию с эдафической водой и переходит в форму аммония (NH4+), который сохраняется в местах катионного обмена почвы. Кроме того, производится гидроксид аммония. Эти соединения являются источником азота.
Вместе с фосфором и калием азот составляет триаду основных питательных веществ растений, необходимых для его роста..
Применение

Иногда включают в состав карамели для регулирования уровня pH.
Аммиачную воду, разбавленную до концентрации 10%, используют в медицинских целях под названием «нашатырный спирт» (не путать с нашатырем — хлоридом аммония):
- с помощью препарата человека выводят из обморочного состояния;
- добавку E 527 используют для обработки ссадин, следов от укусов насекомых: вещество имеет выраженные антисептические свойства, обладает способностью устранять зуд;
- на ее основе изготавливают уникальную аммиачно-камфарную суспензию, нашедшую применение в народной медицине для устранения болей различного характера (зубная, головная, суставная).
Добавка Е 527 в качестве регулятора кислотности, буферного вещества, денатурата входит в состав многих косметических средств:

- краски для волос, препараты для химической завивки, выпрямления. Вещество запускает реакцию распада перекиси водорода, способствует раскрытию волоса;
- шампуни;
- тушь для ресниц, подводка для глаз;
- средства для пилинга;
- отбеливающие маски.
Гидроксид аммония применяют в сельском хозяйстве. На его основе получают соли аммония — ценное азотное удобрение.
Добавка E 527 допущена к применению в России, Беларуси, Украине, странах Евросоюза, США, Канаде. Не имеет разрешения в Австралии.
Допустимая норма не установлена.
В еде
-Он используется в качестве добавки во многие пищевые продукты, в которых он действует как разрыхлитель, регулятор pH и отделочный агент для поверхности пищи.
— Список продуктов, в которых используется гидроксид аммония, обширен и включает выпечку, сыры, шоколадные конфеты, конфеты и пудинги.
-Гидроксид аммония классифицируется FDA как безвредное вещество для пищевой промышленности, если соблюдаются установленные стандарты.
-В мясных продуктах он используется в качестве противомикробного агента, способного уничтожать бактерии, такие как кишечная палочка, уменьшая их до неопределяемого уровня. Бактерии обнаруживаются в кишечнике крупного рогатого скота, адаптируясь к кислой среде. Регулируя pH, гидроксид аммония препятствует росту бактерий.
Основные производители
Добавку Е 527 производят российские предприятия:

- ОАО «Акрон» (город Великий Новгород);
- химическая компания «Щекиноазот» (Тульская область);
- ОАО «Тольяттиазот».
Ведущие зарубежные производители:
- Knuchel Farben AG (Германия);
- Cutrin (Финляндия);
- Lubon Industry Co., Ltd.(Китай).
Гидроксид аммония нельзя назвать полезным для здоровья веществом, но в составе продуктов питания его процент незначителен.
Время от времени в прессе разворачивается компания против закусочных быстрого питания. Скандалы разгораются на фоне слухов, что в Макдональдсе и подобных заведениях мясо обрабатывают аммиачной водой для дезинфекции, получения ровного розового цвета и придания продукту товарного вида. Владельцы ссылаются на разрешающий статус добавки E 527. Под напором общественного мнения небезопасная жидкость была исключена из технологического процесса, ее заменили кислотами (яблочной, муравьиной).
Применение гидроксида аммония
Производство удобрений:
Гидроксид аммония широко используется в производстве удобрений. Он является исходным материалом для получения аммиачной селитры, аммиачного фосфата и других азотно-фосфорных удобрений. Гидроксид аммония используется в процессе нейтрализации аммиака, полученного из аммиачной селитры, и превращения его в аммонийную соль.
Фармацевтическая промышленность:
Гидроксид аммония используется в производстве некоторых лекарственных препаратов. Он может быть использован в качестве реагента для получения определенных соединений, а также для регулирования pH растворов.
Химические лаборатории:
Гидроксид аммония широко применяется в химических лабораториях в качестве реагента. Он может использоваться для регулирования pH растворов, осаждения металлов, а также в других химических реакциях.
Производство чистящих средств:
Гидроксид аммония может быть использован в производстве различных чистящих средств, таких как моющие порошки, жидкости для мытья посуды и другие бытовые средства. Он обладает свойствами, которые позволяют эффективно удалять жир, грязь и другие загрязнения.
Производство косметических средств:
Гидроксид аммония может быть использован в производстве косметических средств, таких как шампуни, кондиционеры и другие средства для ухода за волосами. Он может использоваться для регулирования pH продуктов и обеспечения определенных свойств, таких как разглаживание волос и придание им блеска.
Производство пищевых добавок:
Гидроксид аммония может быть использован в производстве некоторых пищевых добавок. Он может использоваться для регулирования pH продуктов, а также для обработки и консервации пищевых продуктов.
Другие применения:
Гидроксид аммония также может использоваться в производстве бумаги, текстильной промышленности, производстве красок и лаков, а также в других отраслях промышленности.
ссылки
- Ganong, W.F. (2002). Медицинская физиология. 19-е издание. Редакция Современное руководство.
- A. D. Fortes, J. P. Brodholt, I. G. Wood и L. Vocadlo. (2001). Первоначальное моделирование моногидрата аммиака (NH3∙ H2О) и гидроксид аммония (NH4ОН). Американский институт физики. J. Chem. Phys., Vol. 115, No. 15, 15.
- Хельменстин, Анна Мари, доктор философии (6 февраля 2017 г.) Факты о гидроксиде аммония. Получено с: мысли
- Группа Почтека. (2015). Гидроксид аммония. pochteca.com.mx
- Нью-Джерси Здоровье (Н.Д.). Информационный бюллетень по опасным веществам: гидроксид аммония. . Получено от: nj.gov
- Учитель химии. (2018). Гидроксид аммония. Получено от: chemlearner.com
- PubChem. (2018). Гидроксид аммония. Получено из: pubchem.ncbi.nlm.nih.gov
Химическая структура
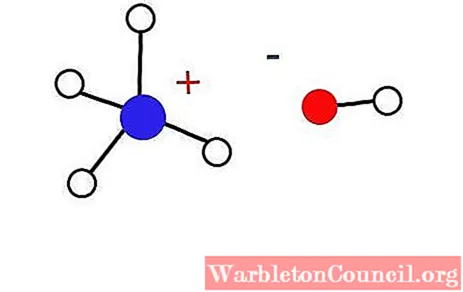
Как указано в его определении, гидроксид аммония состоит из водного раствора газообразного аммиака. Следовательно, внутри жидкости нет определенной структуры, кроме структуры случайного расположения ионов NH.4+ и ОН- сольватированные молекулами воды.
Ионы аммония и гидроксила являются продуктами равновесного гидролиза аммиака, поэтому для этих растворов характерен резкий запах:
Нью-Гемпшир3(г) + Н2O (l) Нью-Гемпшир4+(ac) + OH-(Aq)
Согласно химическому уравнению, высокое снижение концентрации воды приведет к смещению равновесия с образованием большего количества аммиака; то есть при нагревании гидроксида аммония пары аммиака будут выделяться.
По этой причине ионы NH4+ и ОН- им не удается сформировать кристалл в земных условиях, что приводит к тому, что твердое основание NH4ОН не существует.
Это твердое вещество должно состоять только из ионов, взаимодействующих электростатически (как показано на рисунке).
Аммиачный лед
Однако при температурах значительно ниже 0ºC и в окружении огромных давлений, таких как те, что преобладают в ядрах ледяных лун, аммиак и вода замерзают. При этом они кристаллизуются в твердой смеси с различными стехиометрическими пропорциями, являясь самым простым NH3∙ H2O: моногидрат аммиака.
NH3∙ H2O и NH3H 2H2Или это аммиачный лед, потому что твердое тело состоит из кристаллического расположения молекул воды и аммиака, соединенных водородными связями.
Учитывая изменение T и P, согласно вычислительным исследованиям, которые моделируют все физические переменные и их влияние на этот лед, происходит переход фазы NH3∙ нН2Или в фазу NH4Огайо.
Поэтому только в этих экстремальных условиях NH4ОН может существовать как продукт протонирования во льду между NH3 и Н2O:
Нью-Гемпшир3(s) + H2O (s) Нью-Гемпшир4ОН
Обратите внимание, что на этот раз, в отличие от гидролиза аммиака, участвующие виды находятся в твердой фазе. Аммиачный лед, который становится соленым без выделения аммиака
Химические свойства гидроксида аммония
Гидроксид аммония (NH4OH) является щелочным соединением, которое образуется при растворении аммиака (NH3) в воде. Он обладает рядом химических свойств, которые определяют его реакционную способность и применение в различных областях.
Реакция с кислотами:
Гидроксид аммония реагирует с кислотами, образуя соли и воду. Например, при реакции с соляной кислотой (HCl) образуется хлорид аммония (NH4Cl):
NH4OH + HCl → NH4Cl + H2O
Реакция с оксидами и гидроксидами металлов:
Гидроксид аммония может реагировать с оксидами и гидроксидами металлов, образуя соответствующие соли. Например, при реакции с гидроксидом натрия (NaOH) образуется нитрат натрия (NaNO3):
NH4OH + NaOH → NaNO3 + H2O
Реакция с кислотными оксидами:
Гидроксид аммония может реагировать с кислотными оксидами, образуя соответствующие соли. Например, при реакции с оксидом серы (SO3) образуется сульфат аммония (NH4)2SO4:
NH4OH + SO3 → (NH4)2SO4
Реакция с карбонатами и бикарбонатами:
Гидроксид аммония может реагировать с карбонатами и бикарбонатами, образуя соответствующие соли. Например, при реакции с карбонатом натрия (Na2CO3) образуется карбонат аммония (NH4)2CO3:
NH4OH + Na2CO3 → (NH4)2CO3 + H2O
Реакция с оксидом углерода:
Гидроксид аммония может реагировать с оксидом углерода (CO2), образуя карбонат аммония (NH4)2CO3
Эта реакция является важной в процессе получения удобрений и других химических соединений:. NH4OH + CO2 → (NH4)2CO3
NH4OH + CO2 → (NH4)2CO3
Таким образом, гидроксид аммония обладает широким спектром химических реакций, которые позволяют его использовать в различных областях, включая производство удобрений, фармацевтику, а также в качестве реагента в химических лабораториях.
Промышленное и разное
-Он снижает выбросы NOx (высокореактивные газы, такие как оксид азота (NO) и диоксид азота (NO 2 )) в выбросах аккумуляторных батарей и снижает выбросы NOx в дымовые трубы.
-Используется как пластификатор; добавка для красок и для обработки поверхностей.
-Увеличивает пористость волос, позволяя красящим пигментам проникать сильнее, что улучшает результат.
-Гидроксид аммония используется как противомикробное средство при очистке сточных вод. Кроме того, он участвует в синтезе хлорамина. Это вещество выполняет ту же функцию, что и хлор, при очистке воды в бассейне, но имеет то преимущество, что оно менее токсично.
-Он используется в качестве ингибитора коррозии в процессе переработки нефти.
-Он используется в качестве чистящего средства в различных промышленных и коммерческих продуктах, используется на различных поверхностях, включая нержавеющую сталь, фарфор, стекло и духовку.
-Кроме того, он используется в производстве моющих средств, мыла, фармацевтических препаратов и чернил.
риски
-Прикосновение к глазам вызывает раздражение, которое может привести к повреждению глаз.
-Это въедливо. Поэтому при попадании на кожу он может вызвать раздражение, а при высоких концентрациях реагента — ожоги кожи. Повторный контакт гидроксида аммония с кожей может вызвать ее сухость, зуд и покраснение (дерматит).
— Вдыхание спрея гидроксида аммония может вызвать острое раздражение дыхательных путей, характеризующееся удушьем, кашлем или одышкой. Продолжительное или повторяющееся воздействие вещества может привести к рецидивирующим инфекциям бронхов. Также вдыхание гидроксида аммония может вызвать раздражение легких.
— Воздействие высоких концентраций гидроксида аммония может потребовать неотложной медицинской помощи, поскольку может произойти скопление жидкости в легких (отек легких).
— Концентрация 25 ppm была принята в качестве предела воздействия при 8-часовой рабочей смене в среде, где рабочий подвергается вредному воздействию гидроксида аммония.
риски
-При попадании в глаза вызывает раздражение, которое может привести к повреждению глаз.
-Это вызывает коррозию. Поэтому при попадании на кожу может вызывать раздражение, а при высоких концентрациях реагента вызывает ожоги кожи. Повторный контакт гидроксида аммония с кожей может вызвать ее сухость, зуд и покраснение (дерматит).
-Вдыхание аэрозоля с гидроксидом аммония может вызвать острое раздражение дыхательных путей, которое характеризуется удушьем, кашлем или одышкой. Длительное или повторное воздействие вещества может привести к рецидивирующим бронхиальным инфекциям. Кроме того, вдыхание гидроксида аммония может вызвать раздражение легких.
-Воздействие высоких концентраций гидроксида аммония может быть неотложной медицинской помощью, так как может произойти накопление жидкости в легких (отек легких).
-Концентрация 25 частей на миллион была принята за предел воздействия в течение 8-часовой рабочей смены в среде, где работник подвергается вредному действию гидроксида аммония..
реактивность
-Кроме того, из потенциального вреда для здоровья от воздействия гидроксида аммония, есть другие меры предосторожности, которые необходимо учитывать при работе с веществом. -Гидроксид аммония может вступать в реакцию со многими металлами, такими как: серебро, медь, свинец и цинк
Он также реагирует с солями этих металлов с образованием взрывоопасных соединений и выделяет газообразный водород; который, в свою очередь, является легковоспламеняющимся и взрывоопасным
-Гидроксид аммония может вступать в реакцию со многими металлами, такими как: серебро, медь, свинец и цинк. Он также реагирует с солями этих металлов с образованием взрывоопасных соединений и выделяет газообразный водород; который, в свою очередь, является легковоспламеняющимся и взрывоопасным.
-Он может бурно реагировать с сильными кислотами, например: соляной кислотой, серной кислотой и азотной кислотой. Кроме того, он реагирует таким же образом с диметилсульфатом и галогенами.
-Реагирует с сильными основаниями, такими как гидроксид натрия и гидроксид калия, с образованием газообразного аммиака. Это можно проверить, если наблюдается равновесие в растворе, при котором добавление ионов ОН- сдвигает баланс к образованию NH3.
-Медные и алюминиевые металлы, а также другие оцинкованные металлы не должны использоваться при работе с гидроксидом аммония из-за его коррозионного воздействия на них..
номенклатура
Каковы все общие и официальные имена, которые получает NH?4ОН? Согласно тому, что установлено IUPAC, его название — гидроксид аммония, потому что он содержит гидроксильный анион..
Аммоний по нагрузке +1 является одновалентным, поэтому при использовании номенклатурного запаса он называется: гидроксид аммония (I).
Хотя использование термина гидроксид аммония технически некорректно, поскольку соединение не может быть выделено (по крайней мере, не на Земле, как подробно объясняется в первом разделе).
Кроме того, гидроксид аммония получает названия аммиачной воды и жидкого аммиака.
Гидроксид — аммоний
Гидроксид аммония ( аммиачная вода, NH4OH Н2О) представляет собой водный раствор аммиака МН3 в воде. Ион аммония NHJ, хотя он, конечно, не является простым ионом одного элемента, ведет себя подобно ионам щелочных и щелочноземельных металлов, например, образует соли. На воздухе он дымит газообразным аммиаком, имеющим очень резкий запах. Аммиак с парами кислот образует белый дым. Вдыхать аммиак в больших количествах опасно для здоровья.
Гидроксид аммония действует подобно спирту. Гидроксид натрия растворим в крепком растворе гидроксида аммония или в жидком аммиаке, но силикат натрия в них не растворяется. На этом основан процесс очистки гидроксида натрия от небольших количеств силиката натрия, запатентованный Мускатом и Айресом , в котором при определенных высоких концентрациях аммиака и воды слой, обогащенный аммиаком, растворяет гидроксид натрия, тогда как силикат натрия в системе накапливается в несмешивающемся нижнем слое.
Гидроксид аммония ( аммиачная вода, МН4ОН Н2О) пред, ставляет собой водный раствор аммиака NH3 в воде.
Гидроксид аммония также осаждает гидроксид свинца белого цвета, но в этом осадителе РЬ ( ОН) 2 нерастворим.
Гидроксид аммония NH4OH, наоборот, является слабым основанием. Однако ион NH4 близок по свойствам к катиону К и образует несколько аналогичных малорастворимых солей
Очень важно, что соли аммония, в отличие от солей К и Na, разлагаются при нагревании и, следовательно, могут быть удалены прокаливанием.
Гидроксид аммония оттитрован соляной кислотой до нейтральной среды. Правильный ли получится результат.
Гидроксид аммония применяется в производстве текстиля, каучука, лекарств, керамики, используется в фотографии и пищевой промышленности, входит в состав детергентов. Это соединение применяется для извлечения из руд некоторых металлов: меди, никеля, молибдена. Гидроокись аммония используется для отбеливания и удаления пятен. Она находит применение в качестве моющего средства в бытовой химии, а также растворителя казеина при производстве бумаги. Диаммонийфосфат используется для огнестойкой пропитки текстиля, изделий из бумаги и дерева. Он входит в состав удобрений и флюсов для пайки металлов. Хлористый аммоний используется в качестве флюса в процессе оцинковывания листов железа, входит в состав безопасных взрывчатых веществ, лекарств. Кроме того, хлористый аммоний используется при лужении, окраске, нанесении гальванических покрытий и дублении.
Прибавляют гидроксид аммония до слабощелочной реакции. Дают раствору отстояться и примерно через 1 ч приступают к фильтрованию, предварительно проверив полноту осаждения никеля диметилглиоксимом. Фильтруют с отсасыванием через взвешенный тигель Гуча. Осадок промывают на тигле горячей водой, подкисленной азотной кислотой до отрицательной реакции на ион С1 — в промывных водах. Промытый осадок высушивают при ПО — 120 С до постоянной массы.
Прибавляют гидроксид аммония до слабощелочной реакции. Дают раствору отстояться и примерно через 1 ч приступают к фильтрованию, предварительно проверив полноту осаждения никеля диметилглиоксимом. Фильтруют с отсасыванием через взвешенный тигель Гуча.
Раствор гидроксида аммония смешивается с охлаждающим водным раствором и смесь подается противотоком относительно сернистого газа и аммиака, которые при этом абсорбируются с образованием дополнительного количества водного раствора бисульфита аммония. По трубопроводу 43 свежий бисульфит аммония удаляется из отстойника 42 и направляется на стадию варки по мере необходимости. Неабсорбировавшиеся газы выпускаются из колонны 7 по линии 31 в атмосферу. Они безвредны, поскольку содержат углекислый газ, пары воды, азот, другие инертные газы и ничтожно малые количества сернистого газа.
При нагревании гидроксид аммония распадается: NH4OH: — NH3 Н О.
Обычный reagent-grade гидроксид аммония для этой цели не пригоден, если не выдерживать растворитель до следующего дня.
Нет, гидроксид аммония устойчив только в растворе, и даже там он находится только в диссоциированном состоянии. При нагревании водного раствора аммиака из него снова выделяется газообразный аммиак.
Ионное соединение гидроксида аммония NH4OH, по-видимому, практически не существует.
Константа диссоциации гидроксида аммония при 18 и 25 С равна соответственно 17 2 — 10 — 6 и 18ЫО-6.




























