Изучение антагонистов ГнРГ in vivo
В раннем исследовании Heber et al показали, что введение потенциального антагониста ГнРГ кастрированным взрослым крысам мужского пола снижает на 90% уровень сывороточного ЛГ и рецепторов ГнРГ в гипофизе на 24 часа. Авторы предположили, что пролонгированное in vivo подавление гипофизарных рецепторов ГнРГ и секреции ЛГ может быть вызвано медленой скоростью отсоединения антагониста от гипофизарных рецепторов (37). В нашем исследовании (8) самцам крыс были имплантированы подкожно капсулы, выделяющие 50 мкг цетрореликса в сутки, в течение 60 дней. Лечение антагонистом снижало сывороточные уровни ЛГ и тестостерона, однако через 90 дней после прекращения лечения уровни эти гормонов вернулись к контрольному. Сразу после прекращения лечения цетрореликсом было обнаружено значительное подавление уровня гипофизарных рецепторов ГнРГ, однако через 90 дней это явление полностью восстановилось. Эти находки показывают, что восстановление уровней гормонов происходит параллельно восстановлению количества рецепторов ГнРГ, до нормальных значений.
В другом исследовании (79) однократная подкожная инъекция 1,25 мг цетрореликса самцам крыс подавляла сывороточный уровень тестостерона и ЛГ и вызывала значительное подавление количества мембранных рецепторов ГнРГ, длящееся в течение 60 дней (таблица 1). Было также отмечено, что введение 0,5 мг\кг антагониста ГнРГ дважды в день крысам в течение 10 дней снижало на 93% количество свободных рецепторов ГнРГ. Лечение с помощью депонированных форм агониста ГнРГ декапептила или антагониста цетрореликса в течение 8 недель вызывало подавление уровня рецепторов ГнРГ (таблица 2). (109). Эти исследования позволили предположить, что антагонисты ГнРГ, такие как цетрореликс, вызывают блокаду гипофизарно-гонадальной оси не только за счет простого занятия рецепторов ГнРГ, но также и за счет подавления их количества. Изучали паттерн изменений количества и аффинности рецепторов ГнРГ в мембранной фракции передней доли гипофиза крыс после однократного введения 100 мкг цетрореликса (33). Для определения, влияет ли введение цетрореликса на концентрацию связывающих участков ГнРГ, мы использовали in vitro метод десатурации рецепторов, основанный на применении хлорида марганца и тиоцианата аммония (33). Через 6 часов после введения цетрореликса процент занятых рецепторов ГнРГ составил только 10% от общего числа рецепторов, позже не было определено занятых рецепторов. Это исследование продемонстрировало, что гипофизарные рецепторы ГнРГ у крыс значительно подавляются не менее чем на 72 часа после введения цетрореликса. Минимальная концентрация рецепторов была обнаружена через 3-6 часов после инъекции цетрореликса, восстановление числа рецепторов начинается через 24 часа (рис. 1). Подавление количества связывающих участков ГнРГ, вызванное цетрореликсом, сопровождалось подавлением сывороточных концентраций ЛГ и тестостерона (рис. 1). Наши результаты продемонстрировали, что антагонист ГнРГ цетрореликс вызывает выраженное подавление кколичества гипофизарных рецепторов ГнРГ и не менее выраженное занятие связывающих участков.
В другом исследовании (78) мы вводили самцам крыс в течение 4 недель ежедневно подкожно инъекции цетрореликса ацетата или агониста ГнРГ в дозе 100 мкг в сутки. Другой группе крыс вводили однократно внутримышечно инъекцию 4,5 мг цетрореликса пальмоата (депо-форма). Внутривенную стимулирующую пробу с ГнРГ проводили через 4 недели лечения. ГнРГ-стимулированная секреция ЛГ через 30 минут была подавлена на 90 и 96%, соответственно, у крыс, получавших цетрореликс ежедневно или депо, и только на 33% у крыс, получавших агонист ГнРГ. Концентрация гипофизарных рецпторов ГнРГ падала на 69% в группе с агонистом и на 77% и 82% в группе с цетрореликсом ежедневным и депо, соответственно. Введение депо-формы цетрореликса приводило к 75-80% подавлению уровня мРНК гипофизарного рецептора ГнРГ (табл. 3) (78). Анализ dot blot показал 83% снижение уровня мРНК рецептора ГнРГ (рис. 2). Эти результаты демонстрируют, что введение антагониста ГнРГ Цетрореликса вызывает значительное снижение уровня рецептора ГнРГ и транскрипции его гена. Другие исследователи тоже продемонстрировали 67% снижение уровня гипофизарной мРНК рецептора ГнРГ у самцов крыс через 8 часов после введения антагониста ГнРГ Антида (5). Лечение антагонистами ГнРГ, так же как и агонистами, приводило к подавлению количества гипофизарных рецепторов ГнРГ, вопреки противоположным точкам зрения (29).
Менотропины
Эта группа гонадотропинов получена из мочи женщин, находящихся в менопаузе. Выпускается под торговыми названиями – Меногон, Пергонал. В состав препарата входит 75 или 150 МЕ ЛГ и 75 или 150 МЕ ФСГ. Показания для назначения менотропинов:
- стимуляций овуляции у женщин с поликистозом, другими нарушениями гипофиз-яичники;
- стимуляция суперовуляции для ЭКО.
Схема назначения такова: внутримышечно вводится по 75 МЕ/сутки с 7 ого по 12-й день цикла или по 225-375 МЕ через день за 1 неделю. После введения последней дозы Меногона или Пергонала применяют ХГЧ. В том случае, если яичники увеличены чрезмерно, то назначать ХГЧ нельзя из-за риска развития синдрома гиперстимуляции яичников.
Противопоказания для менотропинов:
- опухоль гипофиза и гипоталамуса;
- гиперпролактинемия;
- болезни почек и поджелудочной железы;
- беременность;
- эстрогензависимые опухоли;
- гипертрофия и киста яичников;
- аномальное развитие половых органов.
Побочные действия:
- синдром гиперстимуляции яичников;
- диспепсия;
- аллергические реакции;
- многоплодная беременность;
- кистозное увеличение яичников.
Применение антагонистов ГнРГ для суперовуляции
Десенситизация гипофиза с помощью агонистов ГнРГ требует увеличения сроков лечения, что нежелательно. Теоретически эту проблему можно решить путем однократного применения антагонистов ГнРГ. Благодаря созданию антагонистов ГнРГ третьего поколения, оказывающих незначительное гистаминергическое действие, в скором времени, возможно, можно будет обойтись без десенситизации гипофиза и начать стимуляцию яичников на 2-й день цикла. В этом случае однократное введение антагонистов ГнРГ через 5—6 дней позволит предотвратить всплеск концентрации ЛГ и провести отбор яйцеклеток в удобное время . Применение антагонистов ГнРГ также может позволить уменьшить дозу гонадотропинов и устранить необходимость в поддержании функции желтого тела .
Таблица 1
|
Суммарная частота достижения зачатия (первый курс) |
||
|
Цикл лечения |
Суммарная частота достижения зачатия*, % |
Доверительный интервал 95% вероятности, % |
|
1-й |
16,5 |
15,4-17,6 |
|
2-й |
29,2 |
27,6-30,9 |
|
3-й |
36,5-41,0 |
|
|
4-й |
45,5 |
42,7-48,4 |
|
5-й |
49,8 |
46,3-53,5 |
Примечание. * — медиана 6 циклов (расчетная медиана количества циклов лечения, приводящих к суммарной частоте достижения зачатия 50%). Число пациенток = 4115.
Достигаемая при ИО частота достижения беременности хорошо соотносится с таковой в нормальной популяции, если рассчитывать ее с учетом возраста женщины. Наилучшими показателями для сравнения разных схем лечения являются частота достижения зачатия и частота рождения живого ребенка, рассчитываемые с помощью жизненных таблиц . Эти показатели, полученные в одном из самых крупных исследований, проведенном в женской клинике Лондона/медицинском центре Халлама (London Women’s Clinic/Hallam Medical Centre), приведены в табл. 1 и 2 . После 1 и 6 циклов лечения суммарная частота достижения беременности составила 16 и 58%, а частота рождения живого ребенка — 11 и 42% соответственно. Частота успешного лечения значительно снижалась с увеличением возраста пациенток.
Таким образом, основными факторами, влияющими на частоту достижения беременности, являются возраст женщины (вероятность успеха снижается после 35 лет), длительность бесплодия, а также число отобранных яйцеклеток. Неудивительно, что те женщины, которые смогли достичь беременности, имеют более высокую вероятность повторного достижения беременности при последующих попытках . К настоящему времени многие семейные пары достигли желаемого состава семьи либо путем многократных попыток ИО, либо путем пересадки яйцеклеток, полученных в предыдущих попытках и сохраненных путем замораживания.
Использование гонадотропинов не только дало возможность стимулировать яичники для достижения зачатия in vivo или in vitro, но и предоставило большое количество информации для изучения эндокринных механизмов репродукции.
Таблица 2
Суммарная частота рождения живого ребенка (первый курс)
|
Число пациенток |
Цикл лечения |
Суммарная частота рождения живого ребенка*, % |
Доверительный интервал 95% вероятности, % |
|
3824 |
1-й |
10,5 |
9,6-11,5 |
|
1834 |
2-й |
20,1 |
18,6-21,6 |
|
796 |
3-й |
28,3 |
26,2-30,5 |
|
363 |
4-й |
34,0 |
31,3-36,9 |
|
159 |
5-й |
39,0 |
35,4-42,9 |
Примечание. * — медиана 8 циклов (расчетная медиана количества циклов лечения, приводящих к суммарной частоте рождения живого ребенка 50%).
Для индукции овуляции только одного фолликула, особенно у женщин с ПКЯ, необходимо действовать очень осторожно. Но всегда ли нужны гонадотропины для индукции овуляции у пациенток, не чувствительных к антиэстрогенам? В некоторых случаях может применяться аккуратная лапароскопическая диатермия яичника; известно, что для индукции овуляции необходимо лишь минимальное повреждение яичников
С другой стороны, индукция суперовуляции является одним из самых грубых лечебных воздействий. Однако, получив много яйцеклеток и возможность формирования многих эмбрионов, часть из которых можно заморозить для использования в будущем, ученые смогли достичь значительных успехов в изучении вопросов эмбриологии. В самом деле, достижения эмбриологии могут настолько увеличить вероятность достижения зачатия с помощью единственной яйцеклетки, что отпадает необходимость в проведении суперовуляции для ИО. Столь же реальна перспектива культивирования фолликулов или яйцеклеток in vitro, что позволит совсем отказаться от лечения гонадотропинами!
В настоящее время, однако, гонадотропины являются одним из основных средств лечения бесплодия, несмотря на их высокую стоимость.
Для чего нужна стимуляция яичников
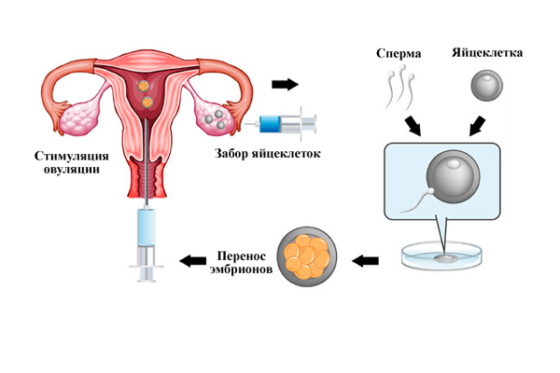
Без правильного формирования и созревания фолликулов и выхода из них готовых к оплодотворению яйцеклеток не может произойти зачатие. Отсутствие овуляции – ановуляция – это признак многих синдромов и болезней женского организма. Повлияв на основу патологии, можно добиться полноценной овуляции.
Женщины с такими заболеваниями имеют ановуляцию как симптом:
- синдром поликистозных яичников;
- синдром истощенных яичников;
- пороки развития гонад;
- задержка развития половой системы при активном росте;
- ановуляция и аменорея на фоне резкого снижения массы тела;
- гиперпролактинемия;
- синдром резистентных яичников;
- синдром гиперторможения гонадотропной функции;
- метаболический синдром.
Эти нарушения сопровождаются бесплодием. Чтобы благополучно зачать ребенка необходимо воздействовать на причины патологии, а для стимуляции овуляции применяют препараты. Все это проводится под контролем лечащего врача, хорошо разбирающегося в репродуктивных технологиях.
После удачной индукции овуляции препаратами, переходят на следующий этап репродукции – ЭКО, или экстракорпоральное оплодотворение. Но для получения достаточного количества жизнеспособных яйцеклеток необходимо принимать препараты для суперовуляции – созревание нескольких фолликулов, в последующем проводится их пункция.
Показания
- Врожденные хромосомные патологии;
- Бесплодие;
- Нерегулярный менструальный цикл;
- Нарушение половых функций;
- Нарушение у детей роста и развития;
- Симптомы патологии гипофиза;
- Гормональная терапия.
ФСГ (FSH, Follicle stimulating hormone, гликопротеидный гонадотропный гормон гипофиза) – это гормон гликопротеиновой группы, который необходим организму для нормальной работы половых желез. Он вырабатывается гипофизом. Результаты данного анализа используются для диагностирования стадии расстройства гормональной регуляции. Снижение уровня ФСГ при наличии дисфункции яичек или яичников может быть свидетельством нарушения работы гипоталамуса или гипофиза. Причиной повышенных показателей может быть первичная патология половых желез. При диагностике бесплодия исследование на гликопротеидный гонадотропный гормон гипофиза назначается вместе с другими анализами. Их результаты интерпретируются в комплексе.
Особого внимание заслуживает диагностика менопаузального периода, в комплекс обследования при которой входит ФСГ. Следуя современным рекомендациям, истощение резерва яичников наблюдается при ФСГ более 10
Это может наблюдаться и после операций на яичниках, а также при преждевременном истощении овариального резерва. Перед планирующимся хирургическим лечением, затрагивающим яичники, также рекомендуется исследовать и ФСГ, и АМГ.
Обычно ФСГ назначают вместе с дополнительным исследованием — АМГ, антимюллеров гормон. При повышении ФСГ отмечается снижение АМГ, что вместе подтверждает синдром истощения яичников, или же наступление климактерического периода.
Также важное значение приобретает диагностика синдрома поликистозных яичников, также известная как диагностика мультифолликулярных яичников. В ходе обследования не только проверяют ФСГ, но и оценивают отношение ЛГ к ФСГ, что при повышении более 2 свидетельствует об изменении структуры яичников и образования СПКЯ
Следует отметить, что изолированно ФСГ может быть назначен только для диагностики менопаузы, хотя более грамотный подход подразумевает обязательную оценку АМГ.
Во всех остальных случаях ФСГ оценивают в комплексе с показателями других половых гормонов.
-
Rubin в гистероскопии. Анестезия при гистероскопии
-
Валериана
-
Прогрессивный панэнцефалит краснухи
-
Вирусный плеврит
- Неотложная помощь при остром коронарном синдроме.
Рак молочной железы
Различные исследования на животных моделях рака молочной железы продемонстрировали снижение количество рецепторов ГнРГ в опухоли параллельно с торможением опухолевого роста.
Szende et al (113) показали, что цетрореликс (25 мкг\сут) вызывает значительное подавление уровня рецепторов ГнРГ в эстроген-зависимой опухоли у мышей, причем через 3 недели наблюдалось более значительное подавление роста, чем при такой же дозе введенного антагониста ГнРГ. Оба аналога так же подавляли уровень рецепторов ЭФР. У крыс с карциномой молочной железы цетрореликс также вызывал регрессию опухоли и уменьшал массу матки и яичников, предположительно за счет уменьшения количества гипофизарных рецепторов ГнРГ (82). При эстроген-независимом раке молочной железы цетрореликс и агонист ГнРГ тормозил опухолевый рост и подавлял количество рецепторов ГнРГ, а также рецепторов ЭФР и ИПФР-1 в опухоли (114). У мышей с MCF-7MIII человеческим раком молочной железы цетрореликс в дозе 30 мкг в сутки и агонист ГнРГ в дозе 25 мкг в сутки полностью останавливали рост опухоли на период 6 недель и снижали количество рецепторов ГнРГ в опухоли (119). Также было показано прямое антипролиферативное действие агонистов и антагонистов ГнРГ на клеточные линии человеческого рака молочной железы in vitro (16, 20, 69, 96, 107). Используя кДНК человеческого гипофизарного рецептора ГнРГ, Kakar et al (48) продемонстрировали экспрессию гена рецептора ГнРГ в клеточной линии человеческого рака молочной железы.
Цитотоксические аналоги ГнРГ с высокой аффинностью связываются с клетками человеческого рака молочной железы (31) и значительно снижают уровень рецепторов ГнРГ в опухолях после введения in vivo (45). У самок мышей с эстроген-независимым мышиным раком молочной железы цитотоксические аналоги AN-207 и AN-152 вызывают подавление на 89% и 93%, соответственно, роста опухоли (115). Специфические высокоаффинные рецепторы ГнРГ были обнаружены в образцах опухоли мышей из контрольной группы (без лечения) и не обнаружились в основной группе, через 15-17 дней введения препарата. В других исследованиях при введении цитотоксического аналога AN-207 мышам с человеческим раком молочной железы не было обнаружено рецепторов ГнРГ в основной группе, и были обнаружены они и их мРНК в значительном количестве в контрольной группе (44). Когда мышам с негормональнозависимым раком молочной железы вводили внутривенно однократную дозу 250 нмоль\кг цитотоксического аналога AN-207, рост опухоли значительно подавлялся через 3 недели (45). Через 3 недели после введения присутствие мРНК рецептора ГнРГ было зафиксировано с помощью ПЦР с обратной транскрипцией во всех группах, а радиорецепторный анализ продемонстрировал наличие высокоаффинных связывающих участков для ГнРГ на мембранах опухолевых клеток в контрольной группе и их отсутствие в основной (табл. 5). Через 60 дней после введения AN-207 высокоаффинные связывающие участки ГнРГ были снова обнаружены (45). Наши результаты показали, что высокоаффинные рецепторы ГнРГ возникают в ткани опухоли снова через какое-то время, что требует повторных введений цитотоксических аналогов ГнРГ с лечебной целью. В прошлых исследованиях мы связывали AN-152, цитотоксический аналог ГнРГ, содержащий доксорубицин, с двухфотонным флюорофором (С625) для изучения клеточного пути вещества в опухоли (117). Используя двухфотонный лазерный сканирующий микроскоп, можно было наблюдать напрямую взаимодействие AN-152 с ГнРГ-рецепторами клеток рака молочной железы и его рецептор-опосредованное вхождение в цитоплазму и ядро (117).
Физиологические эффекты гонадотропных гормонов
ЛГ и ФСГ были названы в соответствии с их действием на яичники; функция этих гормонов у мужчин была изучена позднее. У мужчин ЛГ действует на клетки Лейдига, стимулируя синтез андрогенов, в основном тестостерона. Тестостерон обеспечивает половое влечение, развитие вторичных половых признаков и сперматогенез в извитых семенных канальцах. ФСГ действует на клетки Сертоли, стимулируя образование ими белков и питательных веществ, необходимых для созревания сперматозоидов.
У женщин действие ФСГ и ЛГ более сложно. ФСГ стимулирует рост и развитие фолликулов, а также индуцирует экспрессию гена рецептора ЛГ на текоцитах и клетках гранулярного слоя в яичниках. Кроме того, ФСГ активирует ароматазу в клетках гранулярного слоя, стимулируя синтез эстрадиола. ЛГ действует на текоциты, стимулируя образование в них андростендиона, основного предшественника эстрадиола в яичниках у женщин детородного возраста. ЛГ необходим также для разрыва фолликула при овуляции и для синтеза прогестерона желтым телом. Наконец, связывание ЛГ со своим рецептором на клетках гранулярного слоя увеличивает экспрессию гена рецептора ФСГ, что усиливает действие последнего.
Значение гонадотропных гормонов в регуляции функций половых органов отчетливо выявляется при мутациях генов самих гормонов или их рецепторов (Achermann and Jameson, 1999). У женщин с мутациями генов рецептора ФСГ или β-субъединицы самого ФСГ наблюдаются первичная аменорея и бесплодие, у них не созревают фолликулы, отсутствуют желтые тела и не развиваются молочные железы. Эти данные, а также эффективность ФСГ при некоторых формах бесплодия (см
ниже) красноречиво свидетельствуют о важной роли ФСГ в функционировании яичников. У мужчин при таких же мутациях уменьшен размер яичек и наблюдается олигозооспермия, хотя в некоторых случаях сохраняется фертильность.
Описан только один случай мутации с потерей функции гена β-субъединицы Л Г: у 46-летнего мужчины отсутствовало половое развитие, наблюдались гипоплазия клеток Лейдига и бесплодие. Наружные половые органы у него были развиты по мужскому типу, что, видимо, объясняется синтезом андрогенов под действием ХГ во время внутриутробного развития. Проявления мутаций с потерей функции гена рецептора ЛГ при мужском кариотипе варьируют от мужского гипогонадизма до развития наружных половых органов по женскому типу и отсутствия полового развития. Вероятно, вирилизации наружных половых органов не происходит из-за нарушения действия как ЛГ, так и ХГ во время внутриутробного развития. У женщин, гомозиготных по мутантным аллелям гена рецептора Л Г, отмечаются первичная аменорея или олигоменорея и бесплодие, а при гистологическом исследовании выявляются множественные кисты яичников.
Мутации, ведущие к постоянной активации рецептора ЛГ, возникают преимущественно у мужчин и наследуются аутосом-но-доминантно. Они ведут к преждевременному половому развитию из-за неуправляемого синтеза тестостерона во внутриутробном и в препубертатном периодах. При некоторых из этих мутаций высок риск опухолей яичка.
Применение ГнРГ в медицине

Раньше в медицинской практике применялся натуральный ГнРГ. Исследования по увеличению периода полувыведения препарата привели к созданию аналогов гонадотропин-рилизинг-гормона. Они выпускаются в различных формах и предназначены для введения внутримышечно, подкожно, в виде спрея в нос и в форме капсул для создания внутрикожного депо.
К популярным препаратам — аналогам гонадотропин-рилизинг-гормона относятся:
- Диферелин;
- Бусерелин;
- Золадекс.
Область применения препаратов гонадотропин-рилизинг-гормона очень широка и зависит от его вида и способа введения.
Диферелин назначается для лечения:
- женского бесплодия;
- эндометриоза разных степеней;
- гиперпластических процессов эндометрия;
- при миоме;
- раке молочной железы (рмж);
- в программах искусственного оплодотворения.
У мужчин его применение ограничивается раком предстательной железы с гормональной чувствительностью. Препарат используют у детей для лечения преждевременного полового созревания. Препарат в различных дозировках вводится под кожу.
Назальный спрей Бусерелин и раствор для введения в мышцу эффективен для лечения:
- миомы;
- гиперплазии эндометрия;
- рака груди.
Его назначают до и после операции по поводу эндометриоза для уменьшения патологических очагов. Также используют при проведении ЭКО.
Капсулы Золадекс применяют у мужчин и женщин. Вживление под кожу передней брюшной стенки обеспечивает постоянное поступление гормона. Действие проявляется в снижении тестостерона у мужчин и эстрогенов у женщин, обеспечивая временную обратимую химическую кастрацию.
- Опухоль предстательной железы регрессирует.
- Гонадотропин-рилизинг гормон при рмж (раке молочной железы), чувствительном к эстрогенам, через 3 недели уменьшает размер опухоли.
- Оправдано его назначение для терапии эндометриоза, фибромиомы матки.
Агонисты гонадотропин-рилизинг-гормона

Отдельно выделены препараты, которые по механизму действия являются агонистами гонадотропин-рилизинг-гормона. Это значит, их воздействие на гипофиз вызывает такой же эффект, как и собственный гормон. Под действием желудочного сока действующее вещества распадается, поэтому все препараты вводятся в мышцу, под кожу или интраназально.
Представители этой группы:
- Люкрин Депо;
- Синарел;
- Гонапептил.
Агонисты гонадотропин-рилизинг-гормона применяются до и после хирургического лечения эндометриоза, терапии миомы, перед гистерэктомией (удалением матки), для лечения бесплодия.
Антагонисты гонадотропин-рилизинг-гормона
Препараты Оргалутран, Фирмагон, Цетротид являются антагонистами гонадотропин-рилизинг-гормона. Их действие направлено на торможение выработки лютеинизирующего и фолликулостимулирующего гормонов. Этот эффект применяется в программах ЭКО.
Современные методики искусственного оплодотворения предусматривают стимуляцию овуляции, при которой медикаментозно добиваются созревания нескольких яйцеклеток одновременно, что называют суперовуляцией. Для этого вводят по определенной схеме агонисты ГнРГ.
Этот процесс сопровождается повышением эстрадиола, что может привести к преждевременному пиковому выбросу лютеинизирующего гормона. Овуляция происходит раньше времени, часть яйцеклеток теряется, поэтому их невозможно использовать для оплодотворения.
Антагонисты гонадотропин-рилизинг-гормона связываются с рецепторами ГнРГ. Действие развивается через несколько часов после введения. Продолжительность должна быть такова, чтобы фолликулы смогли вступить в свою завершающую фазу роста и не произошла досрочная овуляция. Уже через 13 часов после его введения гипофиз вновь открыт для стимуляции агонистами ГнРГ, что приводит к суперовуляции и образованию большого количества яйцеклеток.
Использование данной схемы подготовки к оплодотворению уменьшает риск развития синдрома гиперстимуляции яичников, который часто развивался на фоне длительного приема агонистов ГнРГ. Для этого состояния характерно увеличение яичников в размерах, развитие асцита, выпота в плевральную полость, сгущение крови и образование тромбов.
Введение антагониста ГнРГ начинают на 5-6 день после начала применения фолликулостимулирующего гормона или после достижения фолликулом размера 12-14 мм по данным УЗИ. Когда несколько фолликулов достигнут размера 17-19 мм, антагонист отменяют и продолжают стимуляцию по выбранной схеме.
Использование гормональных препаратов сопряжено с различными побочными эффектами. Их тяжесть зависит от общего состояния здоровья пациентов. Выбор оптимального лекарства остается за лечащим врачом.
Юлия Шевченко, акушер-гинеколог, специально для Mirmam.pro
Применение в ветеринарии
Натуральный гормон также используется в ветеринарной медицине в качестве средства для лечения кистозного заболевания яичников у крупного рогатого скота. Синтетический аналог деслорелин используется при ветеринарном контроле репродуктивной функции с помощью имплантата с замедленным высвобождением препарата.
:Tags
Читать еще: Витамин D4 (22-дигидроэргокальциферол) , Ресвератрол , Телмисартан , Триптофан , Фукоксантин (Wakame) ,
Список использованной литературы:
Campbell RE, Gaidamaka G, Han SK, Herbison AE (Jun 2009). «Dendro-dendritic bundling and shared synapses between gonadotropin-releasing hormone neurons». Proceedings of the National Academy of Sciences of the United States of America 106 (26): 10835–40. doi:10.1073/pnas.0903463106. PMC 2705602. PMID 19541658.
Brown RM (1994). An introduction to Neuroendocrinology. Cambridge, UK: Cambridge University Press. ISBN 0-521-42665-0.
Ehlers K, Halvorson L (2013). «Gonadotropin-releasing Hormone (GnRH) and the GnRH Receptor (GnRHR)». The Global Library of Women's Medicine. doi:10.3843/GLOWM.10285. Retrieved 5 November 2014.
Franceschini I, Lomet D, Cateau M, Delsol G, Tillet Y, Caraty A (Jul 2006). «Kisspeptin immunoreactive cells of the ovine preoptic area and arcuate nucleus co-express estrogen receptor alpha». Neuroscience Letters 401 (3): 225–30. doi:10.1016/j.neulet.2006.03.039. PMID 16621281.
Schally AV (1999). «Luteinizing hormone-releasing hormone analogs: their impact on the control of tumorigenesis». Peptides 20 (10): 1247–62. doi:10.1016/S0196-9781(99)00130-8. PMID 10573298.
White SA, Nguyen T, Fernald RD (Sep 2002). «Social regulation of gonadotropin-releasing hormone» (PDF). The Journal of Experimental Biology 205 (Pt 17): 2567–81. PMID 12151363.
Sonis WA, Comite F, Pescovitz OH, Hench K, Rahn CW, Cutler GB et al. (Sep 1986). «Biobehavioral aspects of precocious puberty». Journal of the American Academy of Child Psychiatry 25 (5): 674–9. doi:10.1016/S0002-7138(09)60293-4. PMID 3760417.
Maney DL, Richardson RD, Wingfield JC (Aug 1997). «Central administration of chicken gonadotropin-releasing hormone-II enhances courtship behavior in a female sparrow». Hormones and Behavior 32 (1): 11–8. doi:10.1006/hbeh.1997.1399. PMID 9344687.
DeVries MS, Winters CP, Jawor JM (Jun 2012). «Testosterone elevation and response to gonadotropin-releasing hormone challenge by male northern cardinals (Cardinalis cardinalis) following aggressive behavior». Hormones and Behavior 62 (1): 99–105. doi:10.1016/j.yhbeh.2012.05.008. PMID 22613708.
Brooks LR, Le CD, Chung WC, Tsai PS (2012). «Maternal behavior in transgenic mice with reduced fibroblast growth factor receptor function in gonadotropin-releasing hormone neurons». Behavioral and Brain Functions 8: 47. doi:10.1186/1744-9081-8-47. PMC 3503805. PMID 22950531.
Сохранение беременности.
Предположение, что привычный аборт связан с лютеиновой недостаточностью, у кошек, как и собак, нуждается в подтверждении. Однако приблизительно на 30–45 день с начала беременности у кошек наблюдаются существенные изменения в функционировании желтых тел. Желтые тела, формирующиеся при беременности, отличаются от таковых при ложной беременности, и, вероятно, недостаточная лютеиновая поддержка может вызывать аборт. Для предотвращения аборта практикуется пероральное назначение прогестагенов (мегестрола ацетата 2,5 мг/животное через день до 55 дня беременности), однако такая терапия оправдана лишь в случае подтвержденной лютеиновой недостаточности. Назначение прогестерона в период беременности может вызывать развитие врожденных дефектов у плодов (феминизация плодов мужского пола, крипторхизм), а также задержку родов. Минимально необходимая концентрация прогестерона при беременности у кошек составляет 3 нмоль/л (1 нг/мл). Побочные явления при назначении высоких доз прогестагенов аналогичны наблюдаемым у собак.
Структура
Нобелевские лауреаты Эндрю В. Шалли и Роже Гиймен уточнили в 1977 году характеристики идентификационные ГнРГ: пироГлю-Гис-Трп-Сер-Тир-Гли-Лей-Арг-Про-Гли-NH2. Что является обычным при представлении пептидов, последовательность дается от N-конца к С-концу для представления пептида, как обычно, а также является стандартом пропускать обозначение хиральности, предполагая, что аминокислоты в своей L-форме находятся. Вышеуказанные аббревиатуры относятся к протеиногенным аминокислотам стандартным. Исключение составляет пироГлю — пироглютамовая кислота, производная кислоты глютамовой. На С-конце NH2 указывает, что цепочка заканчивается карбоксидамином вместо свободного карбоксилата.





























