Применение
Кислота ортофосфорная применяется во многих областях, начиная от промышленности до лечения зубов. Средство используется умельцами как флюс при пайке, для очистки поверхности металла от ржавчины. Жидкость применяется:
- для научных исследований в молекулярной биологии;
- как катализатор процессов органического синтеза;
- для создания антикоррозионных покрытий металлов;
- при производстве огнеупорных пропиток для дерева.
Вещество находит применение:
- в нефтяной промышленности;
- при изготовлении спичек;
- для производства кинопленки;
- с целью защиты от коррозии;
- для осветления сахарозы;
- при изготовлении лекарств;
- в холодильных установках как связующее вещество в составе фреона;
- при механической обработке для полировки, очистки металлов;
- в текстильной отрасли при производстве тканей, имеющих огнезащитную пропитку;
- как компонент при получении химических реактивов;
- в ветеринарии для лечения мочекаменной болезни у норок;
- как составляющая для грунтовки по металлу.
В пищевой промышленности
Широкое распространение получило применение фосфорной кислоты при изготовлении продуктов питания. Она зарегистрирована в реестре пищевых добавок под кодом Е338. При употреблении с допустимыми количествами вещество считается безопасным. Полезными являются такие свойства препарата:
- предотвращение прогоркания;
- регулирование кислотности;
- продление срока годности;
- сохранение вкусовых характеристик;
- усиление действия антиоксидантов.
Кислота ортофосфорная как подкислитель, разрыхлитель, антиоксидант находит применение в хлебопечении, мясной, молочной промышленности. Используется при производстве кондитерских изделий, сахара. Вещество придает продуктам кисловатый, горьковатый вкус. Добавка Е338 входит в состав:
- плавленых сыров;
- сдобы;
- газированных напитков – «Пепси-кола», «Спрайт»;
- колбас;
- булок;
- молока;
- детского питания;
- мармелада;
- тортов.

Исследования показали, что злоупотребление продуктами, содержащими ортофосфорные соединения, особенно газированными напитками, может привести к появлению проблем со здоровьем. Не исключено:
- вымывание из организма кальция, что может спровоцировать образование остеопороза;
- нарушение кислотно-щелочного баланса – добавка способна увеличивать его кислотность;
- появление заболеваний ЖКТ;
- обострение гастрита;
- разрушение эмали зубов;
- развитие кариеса;
- появление рвоты.
В непищевой промышленности
Применение ортофосфорной кислоты можно наблюдать во многих сферах производства. Часто это связано с химическими свойствами продукта. Препарат применяется для изготовления:
- комбинированных, фосфорных минеральных удобрений;
- активированного угля;
- фосфорных солей натрия, аммония, марганца;
- огнезащитных красок;
- стекла, керамики;
- синтетических моющих средств;
- огнеупорных связующих компонентов;
- негорючего фосфатного пенопласта;
- гидрожидкостей для авиационной промышленности.
В медицине
Стоматологи применяют ортофосфорный состав для обработки внутренней поверхности коронки. Это помогает во время протезирования улучшить ее сцепление с зубом. Вещество используется фармацевтами для приготовления лекарств, зубного цемента. В медицине применение ортофосфорного соединения связано со способностью протравливать эмаль зуба. Это необходимо при случае использования для пломбирования адгезивных материалов второго, третьего поколения. Важные моменты – после травления поверхность необходимо:
- промыть;
- просушить.

Экология и безопасность
Экстракционным способом, наименее энергозатратным, получается до 95% общего количества кислоты, а оставшиеся 5% приходятся на термический метод. Главный производитель и потребитель экстракционной H3PO4 — США (порядка 90% мировых объёмов), далее в этом списке — Россия и Марокко. Отвалы загрязнённого сульфата кальция, образующиеся при экстракционном способе, нуждаются в утилизации.
Сегодня они сваливаются на суше, затапливаются в водоёмах и лишь незначительная часть используется в качестве сырья для переработки. Сокращение производства в 80-х годах прошлого века было вызвано отказом от фосфорсодержащих растворителей и минеральных удобрений, загрязняющих грунтовые воды.

Ортофосфорная кислота не имеет специфического влияния, обладает слабой системной токсичностью и по степени воздействия на организм человека относится ко второму классу опасности по ГОСТ 12 .1.005. При увеличении концентрации её пары вызывают изменения слизистых оболочек и крошение зубов, а также кожные воспаления.
Работа с препаратом требует применения индивидуальные средства защиты (респиратора, резиновых перчаток, специальных очков) и соблюдения личных правил гигиены. Проглатывание больших количеств вызывает тошноту, диарею и рвоту. Для ликвидации последствий кожные покровы и глаза промывают тёплой водой или физраствором и внутривенно восполняют потери жидкости.
Ортофосфорная кислота. Фосфаты
Ключевые слова конспекта: ортофосфорная кислота, фосфаты
Высшими гидроксидами фосфора являются фосфорные кислоты: ортофосфорная H3РO4, метафосфорная НРО3 и дифосфорная Н4Р2O7.
Ортофосфорная кислота – вещество молекулярного строения. В безводном состоянии образует бесцветные гигроскопичные легкоплавкие (t°пл = 42 °С) кристаллы. Смешивается с водой в любых соотношениях.
Ортофосфорная кислота – слабый электролит, диссоциирует ступенчато:
Ортофосфорная кислота проявляет общие свойства кислот. Она взаимодействует:
а) с основаниями:
б) с основными и амфотерными оксидами:
в) с солями более слабых и летучих кислот:
В отличие от азотной кислоты, ортофосфорная может образовать кислые соли:
2КОН + H3РO4 = К2НРO4 + 2H2OилиКОН + H3РO4 = КH2РO4 + H2O
Окислительные свойства осуществляются только за счёт иона водорода. Однако реакции со многими металлами замедляются из-за образования нерастворимых фосфатов. Например, магний реагирует с фосфорной кислотой, но скорость реакции постепенно уменьшается вследствие образования нерастворимого фосфата на поверхности магния:
При нагревании ортофосфорная кислота теряет воду, превращаясь в дифосфорную кислоту, а затем в полифосфорные кислоты:
2H3РO4 = Н4Р2O7 + H2O
ФОСФАТЫ
Ортофосфорная кислота – трёхосновная, образует три ряда солей: средние – фосфаты Xn(PO4)m (X – катион металла), кислые – гидроортофосфаты Xn(HPO4)m (X – катион металла или NH4+) и дигидроортофосфаты Х(H2РO4)n (X – катион металла или NH4+, n = 1; 2).
Фосфаты – вещества с ионным типом кристаллических решёток, при обычных условиях – твёрдые кристаллические вещества. Фосфаты могут быть окрашены только за счёт катионов металлов. Средние фосфаты плохо растворимы в воде (растворимы только фосфаты Na, К, Rb, Cs), гидрофосфаты и особенно дигидрофосфаты гораздо лучше растворимы в воде. Средние ортофосфаты плавятся без разложения при нагревании при достаточно высоких температурах.
В водных растворах средних фосфатов обязательно происходит гидролиз:
Поэтому водные растворы средних фосфатов имеют щелочную реакцию.
Для фосфатов, в отличие от нитратов, не характерны окислительные свойства, несмотря на то что фосфор находится в высшей степени окисления. Этому способствует симметричная тетраэдрическая структура иона РО43–.
Однако восстановление фосфора в высшей степени окисления +5 возможно. Примером такой реакции может служить промышленное получение фосфора:
Одной из качественных реакций на фосфаты является образование жёлтого осадка при взаимодействии с растворимыми солями серебра:
Конспект урока химии «Ортофосфорная кислота. Фосфаты».
Следующая тема: «».
Фосфаты: другие риски для здоровья
Если вы постоянно употребляете слишком много фосфата, это может иметь дополнительные последствия для здоровья. Слишком большое его количество отрицательно влияет на функцию почек
Пациентам с заболеваниями почек следует обратить на этот факт особое внимание
В экспериментах на животных фосфатные добавки оказались веществами, которые ускоряют возникновение старческих болезней. В дополнение к остеопорозу, это также включает проблемы с мышцами и кожей, а также преждевременную кальцификацию сосудов сердца.
Данная информация относится, в частности, к синтетическим фосфатам. Встречающиеся в природе фосфаты (например, в бобовых, орехах или злаках) присутствуют в значительно меньших количествах и не полностью усваиваются организмом. Искусственные добавки используются организмом гораздо эффективнее, так что уровень фосфатов в нем быстро возрастает.
Чтобы избежать этого, следует, в частности, отказаться от употребления большого количества фаст-фуда. Искусственные фосфаты скрыты не только в фосфорной кислоте, но и во многих других пищевых добавках, которые часто служат консервантами, подкислителями или эмульгаторами. Лучше всего готовить самостоятельно из свежих и полезных ингредиентов, избегать безалкогольных напитков и лимонадов и, как правило, продуктов, прошедших интенсивную обработку.
Список литературы:
Gesundheitsrisiko durch Phosphatzusätze in Nahrungsmitteln, Dtsch Arztebl Int 2012; 109(4): 49-55; DOI: 10.3238/arztebl.2012.0049, Ritz, Eberhard; Hahn, Kai; Ketteler, Markus; Kuhlmann, Martin K.; Mann, Johannes.
Литература
- Букколини Н. В. Фосфорная кислота // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан—Ятрохимия. — С. 153–156. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия. 1994
- Блум У. Адгезивные системы обзор и сравнение// Дент. Арт.- 2003,№ 2.-С.5-11.
- Давыдова А. В. Характеристика адгезивных систем// Материалы научно-практической конференции «Новые технологии в стоматологии».- Ростов на Дону, 2004.-С.45-46
- Enamel-dentin adhesives, self-etching primers// CRA Newsletter. — Vol.24,№ 11. — 2000. —P.1—2.
Фосфорная кислота
В степени окисления +5 фосфор способен образовывать определенные кислоты:
Во многих случаях в химии фосфорной кислотой называют ее водный раствор с концентрацией 85%. Такая жидкость напоминает сироп и не обладает запахом. Соединение характеризуется высокой степенью растворимости в этаноле и других растворителях. Строение фосфорной кислоты выражает структурная формула:
Фосфорная кислота не обладает специфическим токсическим эффектом. Показатели системной токсичности вещества достаточно невысокие. Раствор фосфорной кислоты оказывает раздражающее воздействие на органы зрения и дыхания, слизистые оболочки. Если концентрация соединения превышает 10%, смесь характеризуется раздражающим эффектом, а при 25% содержания вещества раствор вызывает коррозию.
Диссоциация фосфорной кислоты в водных растворах протекает ступенчато:
С каждой новой ступенью диссоциация ослабевает. Полного распада на ионы у фосфорной кислоты не наблюдается. Вещество характеризуется меньшей активностью в процессе химического взаимодействия, по сравнению с серной, азотной, соляной кислотами.
Фосфорная кислота: вредна для костей?
С точки зрения здоровья, фосфорная кислота считается проблемой. Кола, в частности, неоднократно подвергалась критике из-за высокого содержания фосфорной кислоты. Есть подозрение, что регулярное употребление колы ослабляет кости и способствует остеопорозу.
Это происходит потому, что неорганическая кислота мешает организму усваивать кальций. Фосфорная кислота реагирует с молекулами кальция и образует соль. Организм больше не может использовать кальций, связанный таким образом.
Эта проблема затрагивает, в частности, детей и подростков, которые чаще, чем взрослые, пьют колу и другие лимонады. Кроме того, дефицит кальция может иметь в этом случае более серьезные последствия, так как дети находятся в фазе роста.
Однако связь между фосфорной кислотой и остеопорозом научно не доказана.
Советы специалистов
Очищать участки ржавчины нужно очень аккуратно, чтобы не появилось дыр, и метал не слишком истончился. Не рекомендуется во время работ использовать диски с очень крупными абразивными частицами, так как вместо того, чтобы удалять ржавчину, они могут нанести больше вреда, чем пользы.
Перед началом всех ремонтных работ по удалению ржавчины необходимо помнить о том, что это средство очень мощное и сильное. Ведь оно может удалить не только саму ржавчину, но и декоративное покрытие: хром, цинк. Поэтому обрабатывать детали автомобиля необходимо очень внимательно и аккуратно, чтобы не пришлось в дальнейшем тратиться на новые запчасти.
Если все работы по удалению ржавчины с помощью ортофосфорной кислоты были проведены по всем нормативам, то полученная поверхность будет отличаться прочностью и надежностью. И хотя применение преобразователей считается самым востребованным методом при кузовных работах, не стоит забывать и о других известных мастерам вариантах.
На очищенную от толстого слоя ржавчины поверхность наносят немного преобразователя и оставляют на пару минут или часов, в зависимости от концентрации раствора, а затем приступают к дальнейшим ремонтным работам.
Предыдущая МатериалыПрименение виниловой пленки под камуфляж для автомобиля Следующая МатериалыЛучший антикор для автомобиля на сегодняшний день: рейтинг средств для обработки кузова от коррозии
Сферы использования
Фосфорная кислота и её производные нашли широкое применение в самых разнообразных областях жизни человека. Среди основных направлений можно отметить:
- Производство простых фосфорных (суперфосфат и фосфоритная мука), комплексных и сложно-смешанных удобрений.
- Использование кормовых фосфатов в качестве одной из важных добавок в сельском хозяйстве позволяет увеличить среднесуточный прирост в весе у свиней и бычков, повысить продуктивность по молоку и яйценоскости.
- Эфиры и соли широко применяются в изготовлении добавок для умягчения воды и синтетических моющих средств, входят в состав ПАВ при изготовлении цемента. Они связывают ионы кальция и магния, которые отвечают за жёсткость и ухудшают качество стирки.
- В литейном производстве и металлообработке нашлось применение ортофосфорной кислоты от ржавчины — для фосфатирования, в качестве флюса при пайке по нержавеющей стали, чёрным металлам и окисленной меди, для полировки и очистки поверхностей.
- В текстильной промышленности — для огнезащитной пропитки и крашения шерсти и кожи, натуральных и синтетических волокон.
- В химическом производстве она служит катализатором органического синтеза и сырьём для реактивов.
- В авиакосмической области её эфиры являются компонентами гидравлической жидкости двигателей самолётов и антиобледенителей топлива ракет.
- В горнодобывающей и нефтяной промышленности фосфаты натрия применяют для обогащения руд и приготовления буровых суспензий.
- В морозильных агрегатах она входит в состав фреона. А ещё применяется для изготовления различных марок специальных стёкол, в т. ч. оптических, керамики и фарфора, светочувствительных эмульсий для фотобумаги и киноплёнки.
- В производстве огнеупоров фосфаты служат наполнителями огнеупорных бетонов, сырьём для фосфодревесных плит и негорючего пенопласта, огнезащитных ЛКМ (лаков, красок, эмалей, грунтовок и пропиток).
- В медицине её растворами проводят профилактику мочекаменной болезни и проблем желудка. В стоматологии используют для изготовления цементов, составов для протравливания эмали зубов и обработки внутренних поверхностей коронок.
- В деревообрабатывающей промышленности нашёл применение тот факт, что пропитывание фосфорной кислотой делает материал негорючим — придаёт огнестойкость. Например, при изготовлении спичек её 1,5% раствором пропитывают осиновые палочки во избежание тления.
- В пищевой промышленности добавка E338 регулирует кислотность, увеличивает сроки годности, сохраняет вкусовые характеристики и усиливает действие антиоксидантов. Её широко используют пекарские порошки, плавленые сыры, газированные напитки, детские смеси, мармелад и торты, колбасное производство и сахароварение.
Химические свойства
Растворы H3PO4 имеют различный ионный состав, зависящий от кислотности (pH) среды. Как и для всех среднесильных трёхосновных кислот, электролитическая диссоциация фосфорной кислоты является трёхступенчатой, по первой ступени реакция экзотермическая и сопровождается выделением тепла, а по второй и третьей — эндотермическая:
- H3PO4 = H+ + H2PO4-.
- H2PO4- = H+ + HPO42-.
- HPO42- = H+ + PO43-.
При комнатной температуре H3PO4 ведёт себя достаточно инертно, при нагревании проявляет кислотные свойства средней силы и изменяет цвет индикаторов на красный. Она реагирует с металлами, стоящими в ряду активности до водорода: 3Al + 2H3PO4 = Al3 (PO4)2 + 3H2. Вступает в реакции нейтрализации с гидроксидами: 3NaOH + H3PO4 = Na3PO4 + 3Н2О; в реакции обмена — с основными оксидами: 3MgO + 2H3PO4 = Mg3 (PO4)2 + 3H2O.
Нагревание выше 80 °C способствует взаимодействию с пассивными оксидами и силикатами. Поэтому в металлургии широко применяется процесс фосфатирования: защитная плёнка фосфатов образуется на поверхности чугунных, стальных или медных изделий, улучшая их характеристики. Повышение температуры приводит к дегидратации молекулы с образованием пирофосфорной и метафосфорной кислоты:
- 2H3PO4 = H2O + H4P2O7;
- H4P2O7 = H2O + 2HPO3.
Дальнейшее нагревание увеличивает длину цепи, и в результате образуются полифосфорные кислоты (НРО3) n с полимерным строением. Одна только ортофосфорная кислота взаимодействует с нитратом серебра, образуя ярко-жёлтый осадок, тогда как остальные дают белый: H3PO4 + 3AgNO3 = Ag3PO4 + 3HNO3. Поэтому осаждение фосфата серебра служит качественной реакцией на фосфат-ион.
Общая информация
В химическом смысле ортофосфорная кислота имеет слабую интенсивность и является неорганическим соединением.
Добавку Е-338 можно оформить в виде химического выражения, которое будет выглядеть следующим образом: H3PO4.
Применяется, как правило, именно 85% водный раствор. И в этом виде кислота ортофосфорная представляет собой вязкую как сироп жидкость без цвета.
Получают данную добавку разными методами. Например, с помощью реакции взаимодействия серной кислоты и фосфата кальция или гидролиза пентахлорида фосфора. Так же можно ее получить при сжигании фосфора и последующего взаимодействия полученного оксида с водой.
Что такое фосфорная кислота?
Фосфорная кислота представляет собой неорганическую минеральную кислоту без цвета и запаха.
Химическая формула фосфорной кислоты H₃PO₄. Она также называется ортофосфорной кислотой.
Это может быть жидкое, либо прозрачное кристаллическое твердое вещество, вызывающее коррозию металлов, а также тканей человека.
Другие факты об этой кислоте (особенно для любителей науки):
- Фосфорная кислота р = 1,5
- Плотность фосфорной кислоты = 1,8741
- Температура кипения фосфорной кислоты = 158 ° C
- Заряд фосфорной кислоты = 0
Почему фосфорная кислота содержится в коле и других употребляемых продуктах? Производителям продуктов питания и напитков фосфорная кислота нравится. Потому что она дешевая, добавляет терпкость и действует как консервант.
Пищевая промышленность продолжает включать фосфатные добавки в продукты питания. Например, разлитый по бутылкам черный чай может стать напитком с высоким содержанием фосфатов из-за добавок производителя.
Газированные напитки темного цвета, такие как кола, обычно содержат больше, чем другие газированные напитки. Один контейнер с содой может содержать до 500 миллиграммов этой кислоты. Исключением является пиво темного цвета. Оно обычно содержит очень мало этой кислоты.
Почему производители продуктов питания и напитков вообще используют этот химикат? Они используют его для придания своим обработанным продуктам более острого и танжерный вкуса.
Плюс, она также действует как консервант.
Есть много распространенных применений фосфорной кислоты. Это соединение содержится в коле, разлитых по бутылкам и консервированных чаях со льдом, кофейных напитках, батончиках из хлопьев для завтрака. А также в немолочных сливках и в улучшенных куриных и мясных продуктах.
Использование фосфорной кислоты в пищевых продуктах и напитках является законным. А также разрешается регулировать уровень pH в плавленых сырах и других молочных продуктах.
На этикетках фосфорная кислота может быть обозначена следующим образом:
- E338
- ортофосфорная кислота
- фосфорная (V) кислота
- пирофосфорная кислота
- трифосфорная кислота
- о-фосфорная кислота
- гидрофосфат
Научные исследования подтверждают, что прием этой кислоты может иметь ряд возможных последствий для здоровья. Хотя существует много распространенных видов применения фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для удаления ржавчины с металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках, например в Кока-Коле. По вкусу подслащённые слабые водные растворы ортофосфорной кислоты напоминают крыжовник.
Сельское хозяйство
В звероводстве (в частности, при выращивании норок) используют выпойку раствором ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Также её применяют в гидропонных системах для регулировки уровня pH питательного раствора.
Стоматология
Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2-го и 3-го поколений требуется протравливание эмали зуба кислотой с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение, данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесённый адгезив не полностью (не по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удаётся полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность связывания, а также приводят к образованию так называемой «кислотной мины».
С появлением адгезивных материалов 4-го и 5-го поколений стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6-го и 7-го поколений отдельный этап протравливания кислотой отсутствует, так как адгезивы являются самопротравливающимися. Однако некоторые производители всё же рекомендуют для усиления адгезии кратковременно протравливать эмаль даже при использовании самопротравливающих адгезивов.
Химические свойства
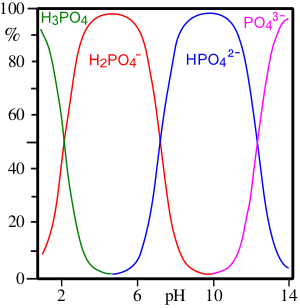
Ионный состав в зависимости от pH раствора
Фосфорная кислота — трёхосновная кислота средней силы. В водных растворах она подвергается диссоциации по трём ступеням c константами диссоциации K1 = 7,1⋅10–3 (pKa1 2,12); K2 = 6,2⋅10–8 (pKa2 7,20); K3 = 5,0⋅10–13 (pKa3 12,32). Экзотермична только диссоциация по первой ступени; по второй и третьей ступени она эндотермична.
-
\displaystyle{ \mathsf{H_3PO_{4(aq)} + H_2O_{(l)} \rightleftharpoons} } \displaystyle{ \mathsf{H_3O^+_{(aq)} + H_2PO^-_{4(aq)}} } \displaystyle{ \mathsf{H_2PO^-_{4(aq)} + H_2O_{(l)} \rightleftharpoons} } \displaystyle{ \mathsf{H_3O^+_{(aq)} + HPO^{2-}_{4(aq)}} } \displaystyle{ \mathsf{HPO^{2-}_{4(aq)}+ H_2O_{(l)} \rightleftharpoons} } \displaystyle{ \mathsf{H_3O^+_{(aq)} + PO^{3-}_{4(aq)}} }
В результате фосфорная кислота может образовывать как средние (фосфаты), так и кислые соли (гидрофосфаты и дигидрофосфаты). Однако при нормальных условиях она малоактивна и вступает в реакции только с карбонатами, гидроксидами и некоторыми металлами. Выше 80 °С фосфорная кислота реагирует также с неактивными оксидами, кремнезёмом и силикатами. Также фосфаты образуются в процессе фосфатирования, при помощи которого чёрные и цветные металлы покрывают защитной плёнкой для улучшения их характеристик.
1. Нагревание фосфорной кислоты приводит к отщеплению воды с образованием пирофосфорной кислоты и метафосфорной кислоты:
- \displaystyle{ \mathsf{2 H_3PO_4 \rightarrow H_2O + H_4P_2O_7}; }
- \displaystyle{ \mathsf{H_4P_2O_7 \rightarrow H_2O + 2 HPO_3}. }
2. Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра: при этом образуется жёлтый осадок, тогда как другие фосфорные кислоты дают белый осадок:
- \displaystyle{ \mathsf{H_3PO_4 + 3AgNO_3 \rightarrow Ag_3PO_4 + 3HNO_3}. }
3. Качественная реакция на ион H2РО4− — образование ярко-жёлтого осадка молибденофосфата аммония при реакции кислоты с молибдатом аммония и азотной кислотой (выступающей в качестве среды):
- \displaystyle{ \mathsf{H_3PO_4 + 12_2MoO_4 + 21HNO_3\rightarrow _3PMo_{12}O_{40}\cdot6H_2O\downarrow + 21NH_4NO_3 +
6H_2O} }
Соли фосфористой кислоты (Фосфиты)
Способы получения фосфитов
Взаимодействие фосфористой кислоты с щелочами:
Н2 + NaOH = NaH + Н2О
Н2 + 2NaOH = Na2 + 2Н2О
взаимодействие фосфористой кислоты с металлами с выделением Н2
Н2 + Ca = Ca + Н2
взаимодействие фосфористой кислоты с оксидами металлов
Н2 + CaO = Ca + Н2O
диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
P4 + 8NaOH(конц) + 4H2O = Na2 + 6H2
Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
PCl3 + 5NaOH(разб) = Na2 + 3NaCl + 2H2O
Физические свойства фосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.
Хорошо растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты плохо растворимы.
Химические свойства фосфитов
Имеют химические свойства, характерные для солей
Применение от ржавчины
Преобразователь ржавчины на основе ортофосфорной кислоты создает на поверхности защитный слой, оберегающий от коррозии при дальнейшем использовании. Особенность применения соединения – безопасность для металла при нанесении. Существует несколько способов выполнить удаление ржавчины ортофосфорной кислотой, зависящих от размера повреждения:
- травление с погружением в ванну, иную емкость;
- многократное нанесение на металл состава пульверизатором, валиком;
- покрытие поверхности предварительно обработанной механической очисткой.
Ортофосфорное соединение производит преобразование ржавчины в фосфаты железа. Состав можно использовать для промывки и очистки:
- изделий металлопроката;
- скважин;
- поверхностей трубопроводов;
- парогенераторов;
- систем водоснабжения, отопления;
- змеевиков;
- бойлеров;
- водонагревателей;
- теплообменников;
- котлов;
- деталей машин и механизмов.
Примечания
- ↑ , p. 679.
- ↑ , с. 153–154.
- ↑ , с. 154.
- ↑ , p. 681.
- ↑ , p. 681–682.
- , p. 683.
- , с. 301.
- ↑ , p. 684.
- ↑ , p. 686.
- , p. 688.
- , p. 689–690.
- ↑ , p. 690.
- ↑ , p. 691.
- . Дата обращения: 5 января 2022.
- ↑ , p. 721.
- . Медпортал. Дата обращения: 7 февраля 2022.
- . РЗ — Онлайн версия журнала Рубежи здоровья (4 марта 2021). Дата обращения: 7 февраля 2022.
- ↑
- ↑
- ↑ (англ.). www.efsa.europa.eu. Дата обращения: 7 февраля 2022.
- ↑ (англ.). .foodingredientsfirst.com/. Дата обращения: 26 марта 2022.
- World Health Organization. . Joint FAO/WHO Expert Committee on Food Additives. Дата обращения: 7 февраля 2022.
- . www.accessdata.fda.gov. Дата обращения: 7 февраля 2022.
Из чего делают пищевую добавку Е338
Для получения ортофосфорной кислоты используют несколько способов. Наиболее экономически выгодным и наименее трудозатратным считается экстракционный метод. Для получения Н3РО4 природные фосфаты обрабатывают с помощью соляной, серной или азотной кислот. В результате химической реакции остается пульпа, которую приходится очищать от примесей, осадков.
Рекомендуем к прочтению: Чем полезен магний, влияние на организм, недостаток и избыток
Более чистый продукт получить можно при использовании термического многоступенчатого метода изготовления. Вначале фосфор сжигают для получения фосфорного ангидрида. Вещество абсорбируют с помощью кислоты, подвергают конденсации и охлаждению.
Пищевая добавка может быть получена при проведении гидролиза фосфора пентахлорида. Также произвести ее удастся путем взаимодействия оксида фосфора (V) с водой.
Консервант Е338, который производят промышленным путем, предназначен для пищевой отрасли, в продажу он поступает в виде вязкой жидкости в полиэтиленовых или стеклянных бутылях
Основные способы получения
Впервые в далёком 1694-м английскому химику Роберту Бойлю удалось синтезировать фосфорную кислоту с применением оксида фосфора (V). Простой метод окисления фосфора разбавленной азотной кислотой и до сегодняшних дней широко используется в лабораториях: 3P + 5NO3 +2H2O = 3H3PO4 + 5NO. Нагревание до кипения безводной фосфористой кислоты приводит к разложению её на ядовитый газ фосфин и ортофосфорную кислоту: 4H3PO3 = 3H3PO4 + PH3.
Промышленное значение имеют два варианта получения: термический и экстракционный. Первый заключается в окислении элементарного фосфора при сжигании до оксида (V): P4 + 5O2 = P4O10; и обработке конечного продукта водой: P4O10 + 6H2O = 4H3PO4.
Технически это реализуется различными способами, названными по аббревиатуре запатентовавших компаний:
- IG-процесс объединяет обе реакции в одной колонне, изготовленной из нержавеющей стали с низким процентным содержанием углерода. Фосфор подаётся сверху при помощи сжатого воздуха или пара и сгорает при температурах свыше 2000 °C. Продукт реакции, оксид фосфора (V), поглощает ортофосфорная кислота, равномерно стекающая по стенкам колонны. Она выполняет одновременно несколько важных функций: растворение P2O5, отведение тепла из зоны горения, защита стенок от пламени. Готовая кислота собирается внизу, охлаждается в теплообменнике и снова поступает в колонну. Продукт IG-процесса практически не имеет в составе низших фосфорных соединений, но требует удаления примесного мышьяка, который всегда загрязняет любой фосфор. Эту проблему решает сероводород: он выделяется при введении в раствор сульфида натрия и осаждает сульфид мышьяка, а затем следует фильтрация.
- TVA-процесс предусматривает отделение процесса горения фосфора от поглощения его оксида. В стальной камере сгорания с внешним охлаждением фосфор соединяется с воздухом, затем продукты реакции подпадают в камеру поглощения, где и становятся ортофосфорной кислотой.
- Хёхст-процесс сгорание и поглощение тоже осуществляет раздельно, но утилизирует теплоту реакции горения для генерирования рабочего пара.
При экстракционном способе производства в России природные фосфаты (апатитовые концентраты из Хибин или фосфориты Каратау) обрабатывают водными растворами неорганических кислот. Это позволяет обеспечивать растущие потребности страны в минеральных удобрениях. Образующийся сульфат кальция присоединяет различное количество молекул воды в зависимости от условий, и по этим признакам экстракционные процессы делят на несколько видов:
- Дигидратные (CaSO4·2H2O). Сырьё измельчают и при температуре от 70 до 80 °C подают в реактор отдельно от серной кислоты. Концентрация готового продукта достигается порядка 30%, а сульфат кальция получается в виде дигидрата. Преимущества: относительно низкая температура, позволяющая избежать коррозии; разнообразие используемых фосфатов; переработка больших количеств. Недостатки: исходное сырьё требует предварительной подготовки (размол), а полученный продукт нуждается в дополнительной концентрации.
- Гемигидратные (CaSO4·0,5H2O). Проводятся при более высоких температурах (от 80 до 100 °C), что позволяет получить устойчивую форму кристаллогидрата — гемигидрат сульфата кальция. Ортофосфорная кислота имеет концентрацию от 40 до 48% и не нуждается в дополнительной обработке.
- Комбинированные гемигидратно-дигидратные процессы — заслуга японских учёных. Сырьё обрабатывается при высоких температурах, а образующийся гемигидрат перекристаллизовывается в дигидрат. Получается практически чистый гипс, побочный продукт реакции. Он с успехом восполняет потребности государственной экономики, не имеющей собственных залежей.
Для концентрирования дигидратного продукта применяют вакуумное испарение, иногда в нескольких последовательно установленных аппаратах. Это не только экономит теплоноситель, но и удаляет фторсодержащие примеси, которые используют в производстве гексафотросиликата водорода H2SiF6. Прочие неорганические загрязнения, соединения мышьяка и кадмия, удаляют осаждением и экстракцией, а чистая кислота перегонкой освобождается от растворителя.
Правила транспортировки и хранения
Ортофосфорную кислоту упаковывают и наносят маркировку по ГОСТ 3885–73 «Реактивы и особо чистые вещества. Правила приёмки, отбор проб, фасовка, упаковка, маркировка, транспортирование и хранение». На таре должен присутствовать символ по ГОСТ 19433–88 «Грузы опасные. Классификация и маркировка». Вещество можно перевозить всеми видами транспорта, руководствуясь их действующими правилами.
Для этого подходят плотно закрывающиеся гуммированные и стальные железнодорожные цистерны, специализированные автоцистерны, пластиковые кубы, бочки и канистры, бутыли из полиэтилена и стекла. Для хранения в упаковке изготовителя используют крытые отапливаемые складские помещения. Чтобы, не изменяя физико-химических свойств, перевести закристаллизованную кислоту в жидкое состояние, используют медленный подогрев до 60 °C.
Правила работы с кислотой
Работа с ортофосфорной кислотой должна происходить в помещении с хорошей вентиляцией. Следует обязательно надеть респиратор для предотвращения попадания едких паров в дыхательные пути и очки для защиты глаз. Если нет под рукой этих защитных средств, то следует воспользоваться маской. Обязательно следует надевать перчатки и защищать открытую поверхность кожи от попадания на нее вещества, т. к. это может привести к ожогам. При попадании ее на кожные покровы следует тщательно промыть их под проточной водой, после чего обратиться за медицинской помощью.
Перевозка реагента должна осуществляться в специальном транспорте, оборудованном железными цистернами, не поддающимися ее разрушительному влиянию. Ее можно перевозить и при помощи других транспортных средств, как сухопутных, так и водных. Но при этом должны быть соблюдены все правила техники безопасности.





























