Технология десульфурации дымовых газов
Одной из самых распространенных технологий десульфурации является метод сухой адсорбции, который основан на использовании сорбента для связывания серы из дымовых газов. Важными факторами при выборе сорбента являются его цена, доступность, механические свойства и способность связывать серу.
Еще одним методом десульфурации является метод сухой окисирующей абсорбции, который основан на применении окислителя для преобразования серы в сульфаты и удаления их из газовой смеси. Такой метод обладает высокой эффективностью, однако его применение требует тщательного контроля процесса окисления и обеспечения безопасных условий работы с окислителем.
Увлажнение дымовых газов является также важным этапом десульфурации. Увлажнение позволяет повысить эффективность процесса адсорбции и окисления, а также уменьшить количество пыли в дымовых газах. Для этого обычно используются специальные системы увлажнения, которые поддерживают оптимальный режим работы.
Все эти технологии десульфурации применяются на промышленных предприятиях, где важно снизить содержание серы в выбрасываемых дымовых газах до приемлемых нормативов. Такие установки должны соблюдать все необходимые требования по безопасности и защите окружающей среды
Химическая структура
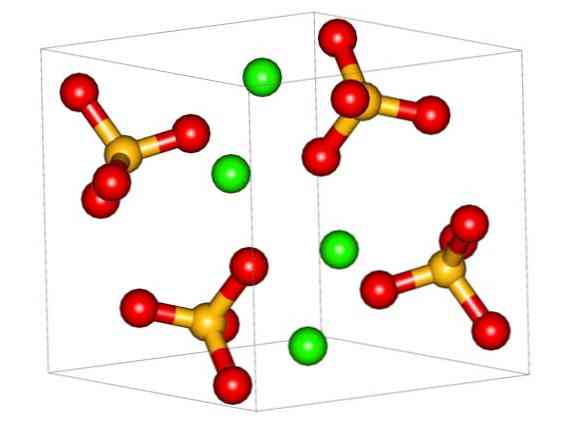
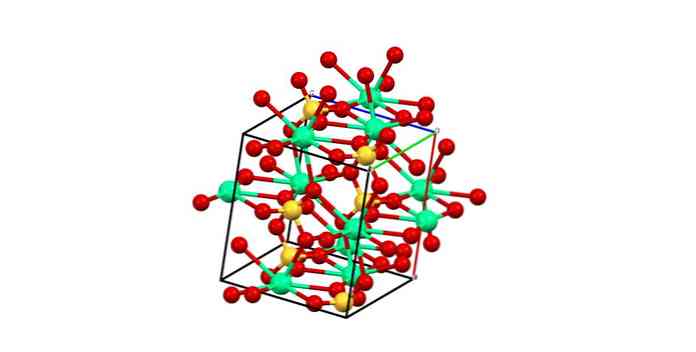
Орторомбическая ячейка для CaSO показана на верхнем изображении4. Здесь предполагается, что взаимодействия являются чисто электростатическими; то есть катионы Са2+ притягивать тетраэдрические анионы SO42-.
Тем не менее, Ca2+ он очень склонен к координации, образуя многогранные структуры вокруг него. Почему это? К электронной доступности кальция, чтобы принять электроны от основных или отрицательных разновидностей (таких как атомы SO)42-).
Учитывая предыдущий пункт, теперь ионы Са2+ они принимают дативные ссылки (предоставленные O), и элементарная ячейка преобразуется, как показано на рисунке ниже:
Следовательно, образуется многогранник CaO8 (зеленая сфера Ca2+ окружен восемью красными сферами O тетраэдров SO4 Рядом). Полиэдры кальция и сульфатные тетраэдры; это кристаллическая структура CaSO4 безводный.
Кроме того, когда кристаллы гидратированы — образуется дигидратированная соль или полугидрат (CaSO 4).4· 1/2 H2O) — структура расширяется, чтобы включить молекулы воды.
Эти молекулы могут быть интеркалированы и координироваться с кальцием; то есть они заменяют одну или две сульфатные группы.
С другой стороны, не вся вода объединяет многогранник CaO8. Некоторые, с другой стороны, образуют водородные мостики с сульфатами. Они служат объединением двух зигзагообразных секций, продуктов расположения ионов в кристалле.
Свойства сульфата кальция и основные характеристики
К другим наименованиям такой пищевой добавки относятся: гипс, кальций сернокислый, ангидрит, селенит, Calcium sulfate, Е516. На французском языке его название звучит, как sulfate de calcium, а на немецком – calciumsulfat.
Это вещество замечательным образом соединяет в себе свойства стабилизатора и эмульгатора. В природе также существует его аналог – серной кислоты кальциевая соль. В естественной среде сульфат кальция формируется из обезвоженных гипсовых отложений, содержится в гипсе и селените, как дигидрат. Жесткость водопроводной воды напрямую связана с концентрацией в ней сульфата калия.
В промышленных масштабах такую добавку получают путем сплавления сульфата калия с хлоридом кальция. В результате такой реакции выпадает осадок, который и является сульфатом кальция.
По внешнему виду это вещество более всего напоминает белый или слегка желтоватый кристаллический порошок горьковато-соленого вкуса и без запаха. Его химический состав включает в себя сернокислый кальций и различные примеси: фториды, селен и другие. Молекулярную формулу вещества можно обозначить в виде: CaSO4.
Этот пищевой эмульгатор практически не растворяется в воде и абсолютно не растворим в этиловом спирте. Однако обладает хорошей растворимостью в глицерине, кислой среде и солях аммония.
Данная пищевая добавка является влаговпитывающим веществом. Она способна поглощать до семи процентов воды от общей массы. Плавится при очень высоких температурах, гигроскопична.
Сульфат кальция формула. Сульфат кальция
| Сульфат кальция | |
|---|---|
 |
|
| Общие | |
| Систематическоенаименование | Сульфат кальция |
| Традиционные названия | кальций сернокислый, «ангидрит» |
| Хим. формула | CaSO4 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 136,1406 г/ моль |
| Плотность | 2,96 г/см³ |
| Термические свойства | |
| Т. плав. | 1450°C (с частичным разложением) |
| Т. разл. | 1560°C |
| Мол. теплоёмк. | 99.660 Дж/(моль·К) |
| −1434,5 кДж/моль | |
| Удельная теплота плавления | 28 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Химические свойства | |
| Растворимость в воде | |
| Классификация | |
| Рег. номер CAS | 7778-18-9 |
| PubChem | 24497 |
| Рег. номер EINECS | 231-900-3 |
| SMILES |
S(=O)(=O). |
| InChI |
1S/Ca.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 OSGAYBCDTDRGGQ-UHFFFAOYSA-L |
| екс Алиментариус | E516 |
| RTECS | |
| ChEBI | 31346 |
| ChemSpider | 22905 |
кальция — бесцветные кристаллы при нормальных условиях — с ромбической кристаллической решёткой, плотность 2,96 г/см³, температура плавления 1450 °C. При повышенных температурах (свыше 1200 °C) может существовать в виде стабильной кубической модификации или двух метастабильных α- и β-гексагональных модификаций. Очень медленно присоединяет воду, гидратируясь до кристаллогидрата с 1/2 или 2 молекулами воды на 1 молекулу сульфата, соответственно CaSO4 · 0,5H2О и CaSO4 · 2H2О. В воде растворим незначительно. Растворимость падает с повышением температуры: если при 20 °C она составляет 0,2036 г/100 г воды, то вблизи точки кипения воды (100 °C) снижается до 0,067 г сульфата на 100 г воды. Растворённый в природной воде сульфат кальция является одним из факторов, определяющих.
При повышении температуры, но не более чем до 180 °C двуводный сульфат кальция теряет часть воды, переходя в полуводный — так называемый «жжёный гипс», пригодный для дальнейшего применения как вяжущее вещество. При дальнейшем нагреве до 220 °C гипс полностью теряет воду, образуя безводный CaSO4, который лишь при длительном хранении поглощает влагу и переходит в полугидрат. Если обжиг вести при температуре выше 220 °C, то получается безводный CaSO4, который влагу уже не поглощает и не «схватывается» при смешивании с водой (это вещество нередко называют «мёртвый гипс»). При дальнейшем нагревании до 900—1200 °C можно получить «гидравлический гипс», который после охлаждения вновь обретает свойства связываться с водой. Первый способ частичной дегидратиции применяют в промышленных условиях для получения полугидрата сульфата кальция (жжёного гипса,) CaSO4 ∙ 0,5H2O, нагревая дигидрат примерно до 140 °C, уравнение реакции: CaSO4 · 2H2О = CaSO4 · 0,5H2О + 1,5H2О.
,илиили получают синтетическим путём — сплавлением CaCl2с K2SO4.
Может быть получен действием серной кислоты на оксид,,,или. Образуется в результате окисленияпри нагреве до 700—800 °C по реакции CaS + 2O2= CaSO4.
, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в, травматологии идля изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела.замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используюти.».
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель. Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства. Так, осушитель Drierite , состоящий из ангидрата с добавкой хлорида кобальта, меняет свою изначально голубую окраску на розовую, что позволяет своевременно отследить момент исчерпания ресурса препарата.
Искусственные кристаллы сульфата кальция, легированные марганцем или самарием, применяются как термолюминесцентный материал.
Также находит применение в пиротехнике в качестве окислителя в осветительных составах, в смеси с алюминием или магнием в отношении гипс алюминий 1:1~2 в зависимости от требований. Используется как в порошкообразном так и в отверженном состоянии.
Сульфат кальция может применяться в качестве коагулянта, например, при изготовлении.
Химическая формула
Химическая формула соединения Cаso4 обозначает использование кальция (Са), серы (S) и кислорода (O) в соотношении 1:1:4. Формула указывает на то, что в каждом молекулярном соединении CaSO4 содержится один атом кальция, один атом серы и четыре атома кислорода. Формула также показывает, что соединение Саso4 обладает положительным и отрицательным ионами.
В химии формулу соединения записывают с помощью химических символов элементов и индексов, которые указывают на количество атомов каждого элемента. Например, число 4 в формуле CaSO4 говорит о том, что в соединении Саso4 присутствует 4 атома кислорода.
Химическая формула Саso4 позволяет идентифицировать и классифицировать соединение, а также предсказывать его свойства. Например, вода расщепляется на кислород и водород при воздействии электрического тока, а химическая формула H2o говорит о том, что в одной молекуле воды присутствуют два атома водорода и один атом кислорода.
| Элемент | Символ |
|---|---|
| Кальций | Са |
| Сера | S |
| Кислород | O |
Извлечение из отходов производства гипса
Один из промышленных методов извлечения гипса из отходов производства включает стадию мельчения отходов, смешивания их с водой и последующего долговременного осаждения сульфата кальция. Полученный осадок очищается от примесей и просушивается для получения сульфата кальция высокой чистоты.
Лабораторные эксперименты показали, что извлечение гипса из отходов производства можно осуществить с использованием различных растворителей, таких как уксусная кислота или серная кислота. Растворение отходов в растворителе происходит при повышенной температуре и давлении. Полученное растворение фильтруется для удаления несвязанных примесей и затем подвергается процессу кристаллизации для получения сульфата кальция в виде гипса.
Извлечение гипса из отходов производства является важным направлением в области утилизации промышленных отходов. Это позволяет не только снизить негативное воздействие на окружающую среду, но и получить ценное сырье для различных отраслей промышленности.
Дополнительно
Находится в природе в виде дигидрата CaSO4 ∙ 2H2O (гипс, селенит) и в безводном состоянии — ангидрит.
Безводный сульфат кальция — бесцветные кристаллы, плотность 2,96 г/см³, температура плавления 1450 °C. Очень медленно присоединяет воду. В воде растворим незначительно. При повышении температуры до 220°C двуводный гипс полностью теряет воду, образуя безводный CaSO4, который лишь при длительном хранении поглощает влагу и переходит в полугидрат. Однако если обжиг вести при температуре вышЕ-220°C, то получается безводный CaSO4, который влагу уже не поглощает и не «схватывается» при затворении водой. В промышленных условиях также получают полугидрат сульфата кальция (алебастр)CaSO4 ∙ 0,5H2O путем нагревания дигидрата примерно до 140°C, по уравнению реакции: CaSO4·2H2О = CaSO4·0,5H2О + 1,5H2О.
Описание с предварительным предупреждением
Безводный сульфат кальция является предметом данного уведомления, даже если в классификации использования или добавок часто глобально и неопределенно упоминается семейство сульфатов кальция. Сульфат кальция не следует путать с дигидратом сульфата кальция , будь то гипс в его естественной форме или алебастр, компактная разновидность гипса с полупрозрачными или белесыми микрокристаллами. Его ни в коем случае нельзя ошибочно отождествлять с гипсом , гипсом или полугидратом сульфата кальция или бассанитом .
Точно так же ошибочно отождествлять его с техническим осушителем на основе растворимого ангидрита, которым является технический дриерит . Растворимый пористый ангидрит не имеет такой структуры.
В обычных лабораторных условиях он появляется в виде порошкообразного кристаллического твердого вещества, бесцветного, белого или слегка окрашенного, которое может быть определено, например, как кальциевая соль серной кислоты. Однако существует несколько полиморфных форм , отличных от ангидрита с ромбоэдрической сеткой, в частности триклинные, гексагональные или моноклинные сетчатые формы, характеризующиеся, в частности, все более низкими плотностями и показателями преломления. Моноклинная форма более стабильна при высоких температурах плавится при 1450 ° С .
Ангидрит, который трудно получить в виде крупных кристаллов, плохо растворяется в чистой воде, т.е. 0,298 г на 100 г чистой воды при 20 ° C и 0,1619 г при 100 ° C. При растворении в воде сульфат кальция выпадает в осадок, вызывая образование гипса.
Он растворим в кислотах, а также в разбавленных растворах солей аммония или пероксодисульфата натрия.
Применение в разных сферах
Наиболее распространенными областями применения сульфата кальция являются пищевая отрасль, медицина и косметологическая промышленность.
В сфере приготовления продуктов питания эта пищевая добавка используется как самостоятельное вещество или в совокупности с другими эмульгаторами и стабилизаторами.
Такую пищевую добавку используют в различных целях:
- для улучшения структуры растительной ткани, большей сохранности полезных веществ, а также повышения термостойких свойств применяется для консервирования томатов;
- для регулирования кислотности в виноградном сусле применяют французские виноделы при изготовлении вин;
- для улучшения текстуры и качества сгустка используется для приготовления тофу, домашнего сыра и творога;
- для нормализации pH уровня в солодовом заторе при изготовлении пива;
- в качестве питательного вещества для различных микроорганизмов в производстве хлебопекарных дрожжей;
- для повышения пластичности теста и его эластичности, улучшения качества муки и защите ее от порчи применяется в изготовлении хлебобулочных изделий;
- для связывания компонентов при производстве замороженных продуктов из рыбы.
К тому же данное вещество часто применяется в диетологии в качестве заменителя соли.
В медицинской сфере сернокислый кальций используют для изготовления хирургических фиксирующих повязок. В недалеком прошлом это был единственный материал, который использовался для оттисков зубов в стоматологической практике.
Широко распространен сульфат кальция в косметологической промышленности. Его применяют в качестве одного из компонентов для приготовления альгинатных масок с морскими водорослями.
Вещество разводят в воде, наносят на лицо, а после снимают также, как и резиновую маску. Благодаря своим пластифицирующим свойствам сульфат кальция способствует быстрому застыванию такой маски.
При совмещении порошка сернокислого кальция с водой, получают вязкую гомогенную субстанцию, которую наносят на лицо и тело, получая так называемую питательную термическую маску.
После застывания полученная смесь имеет свойство нагреваться, что способствует лучшему раскрытию пор и ускорению проникновения необходимых веществ в клетки кожи. Можно найти данное вещество в декоративной косметике в качестве матирующего компонента, а также в скрабах, где он популярен как абразив.
Сульфат кальция считается повсеместно разрешенным продуктом, максимальная суточная доза его не регламентируется.
Физические свойства:
| 200 | Физические свойства | |
| 201 | Плотность | |
| 202 | Температура плавления | |
| 203 | Температура кипения | |
| 204 | Температура сублимации | |
| 205 | Температура разложения* | |
| 206 | Температура самовоспламенения смеси газа с воздухом | |
| 207 | Удельная теплота плавления (энтальпия плавления ΔHпл) | |
| 208 | Удельная теплота испарения (энтальпия кипения ΔHкип) | |
| 209 | Удельная теплоемкость при постоянном давлении | |
| 210 | Молярная теплоёмкость | |
| 211 | Молярный объём | |
| 212 | Теплопроводность | |
| 213 | Коэффициент теплового расширения | |
| 214 | Коэффициент температуропроводности | |
| 215 | Критическая температура | |
| 216 | Критическое давление | |
| 217 | Критическая плотность | |
| 218 | Тройная точка | |
| 219 | Растворимость в воде и иных жидкостях | |
| 220 | Давление паров (мм.рт.ст.) | |
| 221 | Давление паров (Па) | |
| 222 | Стандартная энтальпия образования ΔH | |
| 223 | Стандартная энергия Гиббса образования ΔG | |
| 224 | Стандартная энтропия вещества S | |
| 225 | Стандартная мольная теплоемкость Cp | |
| 226 | Энтальпия диссоциации ΔHдисс | |
| 227 | Диэлектрическая проницаемость | |
| 228 | Магнитный тип | |
| 229 | Точка Кюри | |
| 230 | Температура Нееля | |
| 231 | Объемная магнитная восприимчивость | |
| 232 | Удельная магнитная восприимчивость | |
| 233 | Молярная магнитная восприимчивость | |
| 234 | Электрический тип | |
| 235 | Электропроводность в твердой фазе | |
| 236 | Удельное электрическое сопротивление | |
| 237 | Сверхпроводимость при температуре | |
| 238 | Критическое магнитное поле разрушения сверхпроводимости | |
| 239 | Запрещенная зона | |
| 240 | Концентрация носителей заряда | |
| 241 | Твёрдость по Моосу | |
| 242 | Твёрдость по Бринеллю | |
| 243 | Твёрдость по Виккерсу | |
| 244 | Скорость звука | |
| 245 | Поверхностное натяжение | |
| 246 | Динамическая вязкость газов и жидкостей | |
| 246 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 247 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 248 | Предел прочности на растяжение | |
| 249 | Предел текучести | |
| 250 | Предел удлинения | |
| 251 | Модуль Юнга | |
| 252 | Модуль сдвига | |
| 253 | Объемный модуль упругости | |
| 254 | Коэффициент Пуассона | |
| 255 | Коэффициент преломления |
См. также
- Сульфаты
- Пищевые добавки
- Штукатурка
- Гипсокартон
Соединения кальция
Алюминаты кальция (mCaO·nAl2O3) • Алюмогидрид кальция (Ca[AlH4]2) • Амид кальция (Ca(NH2)2) • Арсенат кальция (Ca3(AsO4)2) • Ацетат кальция ((CH3COO)2Ca) • Бисульфид кальция (Ca(HS)2) • Борат кальция (Ca3(BO3)2) • Бромид кальция (CaBr2) • Вольфрамат кальция (CaWO4) • Гексаборид кальция (CaB6) • Гексафторсиликат кальция (CaSiF6) • Гидрид кальция (CaH2) • Гидроксид кальция (Ca(OH)2) • Гидроортофосфат кальция (CaHPO4) • Гипофосфит кальция (Ca(PH2O2)) • Гипохлорит кальция (Ca(ClO)2) • Глицерофосфат кальция (C3H7CaO6P) • Глюконат кальция (C12H22CaO14) • Дигидрокарбонат кальция (Ca(HCO3)2) • 2,5-дигидроксибензолсульфонат кальция (C12H10CaO10S2) • Дигидроортофосфат кальция (Ca(H2PO4)2) • Иодат кальция (Ca(IO3)2) • Иодид кальция (CaI2) • Карбид кальция (CaC2) • Карбонат кальция (CaCO3) • Моносилицид кальция (CaSi) • Нитрат кальция (Са(NО3)2) • Нитрид кальция (Ca3N2) • Оксалат кальция (СаС2О4) • Оксид кальция (CaO) • Ортофосфат кальция (Ca3(PO4)2) • Перманганат кальция (Ca(MnO4)2) • Пероксид кальция (CaO2) • Пирофосфат кальция (Ca2P2O7) • Силикат кальция (CaSiO3) • Силицид дикальция (Ca2Si) • Силицид кальция (CaSi2) • Сульфат кальция (CaSO4) • Сульфид кальция (CaS) • Сульфит кальция (CaSO3) • Тетрагидроалюминат кальция (Ca(AlH4)2) • Титанат кальция (CaTiO3) • Триметафосфат кальция (Ca3(P3O9)2) • Флюорит (CaF2) • Формиат кальция (Ca(HCOO)2) • Фосфид кальция (Ca3P2) • Фторид кальция (CaF2) • Хлорат кальция (Ca(ClO3)2) • Хлорид кальция (CaCl2) • Хлорная известь (Ca(Cl)OCl) • Хромат кальция (CaCrO4) • Цианамид кальция (CaCN2) • Цианид кальция (Ca(CN)2) • Цитрат кальция (Ca3(C6H5O7)2) •
Растворимость кислот, оснований и солей в воде
| H+ | Li+ | K+ | Na+ | NH4+ | Ba2+ | Ca2+ | Mg2+ | Sr2+ | Al3+ | Cr3+ | Fe2+ | Fe3+ | Ni2+ | Co2+ | Mn2+ | Zn2+ | Ag+ | Hg2+ | Hg22+ | Pb2+ | Sn2+ | Cu+ | Cu2+ | |
| OH− | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | — | — | — | Н | Н | — | Н | |
| F− | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | ? | Р |
| Cl− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I− | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO32− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO42− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2− | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO43− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO32− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | — | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO− | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN− | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO32− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Сульфаты
Алюм (KAl(SO4)2•12H2O) • Аммоний сульфата алюминия ((NH4)Al(SO4)2) • Аммоний-железо сульфат (NH4Fe(SO4)2) • Аммоний-железо(II) сульфат ([NH4]2[SO4]2) • Аммоний-железо(III) сульфат (NH4Fe(SO4)2) • Аммоний-церий(IV) сульфат ((NH4)4Ce(SO4)4) • Гептагидрат сульфата магния (MgSO4) • Гидросульфат аммония ((NH4)HSO4) • Гидросульфат калия (KHSO4) • Гидросульфат натрия (NaHSO4) • Дисульфат калия (K2S2O7) • Дисульфат натрия (Na2S2O7) • Железа(III) основный сульфат ([Fe3(SO4)5](OH)2) • Квасцы • Купорос • Оксид-сульфат титана (TiOSO4) • Олеум (H2SO4•xSO3) • Пиросерная кислота (H2S2O7) • Серная кислота (H2SO4) • Соли Туттона • Сульфат актиния(III) (Ac2(SO4)3) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюмонатрия (NaAl(SO4)2) • Сульфат аммония ((NH4)2SO4) • Сульфат бария (BaSO4) • Сульфат бериллия (BeSO4) • Сульфат ванадила (VOSO4) • Сульфат ванадия(III) (V2(SO4)3) • Сульфат висмута (Bi2(SO4)3) • Сульфат гидроксиаммония ((NH3OH)2SO4) • Сульфат железа(II) (FeSO4) • Сульфат железа(III) (Fe2(SO4)3) • Сульфат индия(III) (In2(SO4)3) • Сульфат иридия(III) (Ir2(SO4)3) • Сульфат кадмия (CdSO4) • Сульфат калия (K2SO4) • Сульфат кальция (CaSO4) • Сульфат кобальта(II) (CoSO4) • Сульфат кобальта(III) (Co2(SO4)3) • Сульфат лития (Li2SO4) • Сульфат магния (MgSO4) • Сульфат марганца(II) (MnSO4) • Сульфат марганца(III) (Mn2(SO4)3) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфат натрия (Na2SO4) • Сульфат никеля(II) (NiSO4) • Сульфат олова(II) (SnSO4) • Сульфат празеодима (Pr2(SO4)3) • Сульфат ртути(I) (Hg2SO4) • Сульфат ртути(II) (HgSO4) • Сульфат свинца(II) (PbSO4) • Сульфат серебра (Ag2SO4) • Сульфат стронция (SrSO4) • Сульфат сурьмы (Sb2(SO4)3) • Сульфат таллия(I) (Tl2SO4) • Сульфат таллия(III) (Tl2(SO4)3) • Сульфат тетраамина меди (Cu(NH3)4SO4) • Сульфат титана(III) (Ti2(SO4)3) • Сульфат титана(IV) (Ti(SO4)2) • Сульфат урана (U(SO4)2) • Сульфат уранила (UO2SO4) • Сульфат хрома(III) (Cr2(SO4)3) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфат цезия (Cs2SO4) • Сульфат церия(IV) (Ce(SO4)2) • Сульфат цинка (ZnSO4) • Сульфат циркония (Zr(SO4)2)
| Это заготовка статьи о неорганическом веществе. Вы можете помочь проекту, исправив и дополнив её. |
приложений

В строительстве и в искусстве
Это используется в разработке штукатурки, чтобы создать стены домов и других построек, которые способствуют его украшению. Кроме того, рельефы производятся через пресс-формы на крышах и оконных рамах. Штукатурка также в потолках.
Сульфат кальция используется, чтобы помочь решить проблему, которая возникает при гидратации бетона, таким образом, сотрудничая в строительстве дорог, проспектов и т. Д..
С помощью штукатурки изготавливаются скульптуры, особенно религиозные деятели, а на кладбищах используются надгробия..
терапевтический
ветеринарный
Экспериментально, стерильные кусочки сульфата кальция использовались в ветеринарии для восстановления дефектов костей или полостей, таких как оставленные раны или опухоли.
Пластырь или пластырь Парижа можно использовать для восстановления дефектов костей благодаря их уникальной способности стимулировать остеогенез. Рентгеновские и технециевые исследования (Tc99m) подтверждают использование парижского пластыря в качестве аллопластика и его остеогенную способность при имплантации в лобную пазуху.
Регенерация кости была продемонстрирована у шести собак в период от 4 до 6 месяцев. Сульфат кальция начал использоваться в этой области в 1957 году в виде парижских гипсовых таблеток, заполняющих дефекты костей собак..
Замена кости сульфатом кальция сопоставима с таковой, наблюдаемой в аутогенной кости.
Ruhaimi (2001) применил сульфат кальция в недавно разрушенной кости челюсти кролика, наблюдая увеличение остеогенеза и кальцификации костей.
медицина
Сульфат кальция используется в медицине для иммобилизации суставов, которые перенесли вывихи и переломы костей, в дополнение к тому, что используется в качестве вспомогательного вещества при изготовлении таблеток.
лечение зубов
В стоматологии его используют как основу для изготовления зубных протезов, реставраций и оттисков зубов..
При приготовлении пищи
Он используется в качестве коагулянта при разработке тофу, пищи, приготовленной из сои, и широко используемой в восточных странах в качестве заменителя мяса. Кроме того, он был использован в качестве пищевого укрепляющего агента и при обработке муки.
В качестве удобрения и кондиционера для сельскохозяйственных почв
Гипс (CaSO4· 2Н2O) использовался в качестве удобрения в Европе с 18-го века, имея преимущество перед использованием извести в качестве источника кальция для большей мобильности.
Кальций должен быть доступен для корней растений для правильного снабжения. Затем добавление кальция улучшает садовые и арахисовые культуры (арахис).
Гниль корня арахиса, производимого биологическими патогенами, а также апикальная гниль арбуза и томата частично контролируются применением сельскохозяйственного гипса..
Гипс помогает уменьшить рассеивание глины, вызывая образование корок на земле. Уменьшая корки, образующиеся на земле, штукатурка облегчает выход рассады. Это также увеличивает поступление воздуха и воды на землю.
Гипс помогает улучшить почву, уменьшая кислотность и токсичность алюминия, тем самым адаптируя культуру к натриевым почвам..
При производстве других соединений
Сульфат кальция реагирует с бикарбонатом аммония с образованием сульфата аммония. Он также был использован в процессе производства серной кислоты.
Безводный сульфат кальция смешивают со сланцем или бедным и, когда смесь нагревается, триоксид серы выделяется в газообразной форме. Оксид серы является предшественником серной кислоты.